标准品(对照品)使用中常见问题,主要包括:
1).对照品含量,
2).储存运输温度,
3).新老批次,
4).产品稳定性
5).残留溶剂对照选择
6).剧毒对照品
7).对照品质量标准和复测
一、1.1EP对照品含量问题:
Q:我在哪里可以找到测定中使用的化学参考标准的指定含量?
A:CRS分析的指定内容在我们的在线目录中提供的说明书中提供,用于定性分析(HPLC,TLC),因此您无法找到标准纯度的信息。其他CRS用于定量分析(测定确定),在这种情况下,标准纯度被公布。
如果CRS没有定量内容,则在任何情况下都不应将其解释为含量为100%。 对于含量测定,必须明确指明含量,在任何情况下,用户都不应将其视为100%。
但是,当一个杂质对照品用于相关物质检测或控制相应杂质时,如果没有指明含量,则为了估算,则视其为100%。
Q:为啥有时候EDQM(EP)对照品的双标签?
A:EDQM将要把当前所有标准品的外包装瓶上帖上双层标签,目前已经有大部分产品被换成双层标签了,但还有少数部分还没被贴到,还是单层标签。贴双层标签的目的是为了便于使用者在做实验(特别是做申报)时,把外面的一层标签揭下来贴在所写的实验记录中,以证实这个产品的来源(这里有部分客户看着是双标签误以为是贴牌啥的,这是误解)。
Q:EDQM(EP)对照品瓶子和报告批次不完全一致?
A:1、EP小批次的情况--在具体情况下,由于填装和贴标等原因,小批次均是由同一批次的大包装原料药提出来的(比如实物瓶子上的批次信息是batch1.1,1.2,1.3等,但是随货COA却是batch 1.0,2.0,3.0,其实是一样的,之前有多次遇到客户提及,故作说明)。
二、储存,运输温度差异
标准品(对照品)的储存,运输温度有何差异?
A:常见的标准品的保存方法有:
1.常温保存:通常用于化学性质比较稳定的标准品,建议保存于干燥阴凉的地方。
2.+4度冷藏:用于常温下不是很稳定的物质,保存于实验室冷藏箱中(可控温度)。
3.-20度冷冻:用于化学性质不稳定,常温下容易分解的物质。
4.-80度保存:一些具有生物活性的物质,需要保存于特定的-80度的冰箱。
运输条件:相对于长期保存的条件,运输过程由于时间比较短,所以运输条件相对来说要求没有保存条件那么严格。长期保存条件为常温和+4度的标准品都可以在常温条件下运输,-20度保存的标准品在运输时可以放入冰袋来降低温度,而-80度保存的物质则需要在运输时加入干冰。但是干冰的有效时间只能维持1天左右,所以这类型的物质不适合于长途运输。
三、标准品(对照品)的新老批次变更:
药典标准品如何保证在效期内使用?
A:大部分国家药品标准物质不设有效期,而是对现行有效的在售批次进行持续的质量稳定性监测。一旦发现量值不适用,将立即发布停用通知。某品种现售批次的前一批次标准物质,若官方没有发布停用通知或公布有效使用期限,按说明书规定的条件保存,中检院一般在6个月内可以正常使用; EP的可以参考EP在线标准品数据库; USP的通常是在当前批次售完后的3-12个月。
对于法定标准品,都建议用户随用随买或根据生产和检验计划来购买,不要事先大量囤积,因为一旦新批号开始对外供应了,将不再对老批号进行质量监测,用户如若继续使用,其特性量值及适用性请自行验证。
Q:新批出来了,是不是旧批就不能用了?
1.中检所的
A:原则上是,中检院对仓储的在售标准物质进行质量监测,一旦发现量值不适用,将立即在中检院网站发布停用通知。某品种现售批次的前一批次标准物质,若中检院没有发布停用通知或公布有效使用期限,按说明书规定的条件保存,一般在6个月内可以正常使用。建议用户随用随买或根据生产和检验计划来购买,不要事先大量囤积,因为一旦新批号开始对外供应了,我院将不再对老批号进行质量监测,用户如若继续使用,其特性量值及适用性请自行验证。
2.EP
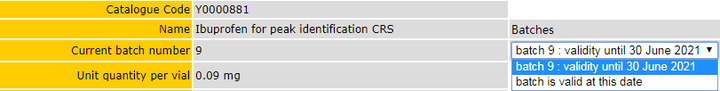
参考链接:
3.USP
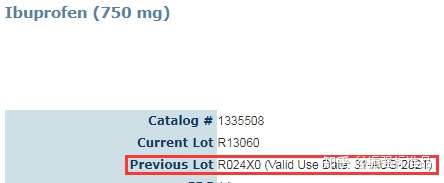
参考链接:
四、标准品(对照品)的稳定性:
Q:由于对照品包装规格大,需要反复使用多次才能用完,如何确保产品的稳定性?
A:对照品的稳定性,一般而言,来源于监管当局认可机构的对照品,只要是能够按照提供者推荐的贮存条件保存,无需再开展稳定性研究。对于其他来源的对照品,应考虑开展稳定性研究,包括质量标准中对照品使用时需要配制成的溶液稳定性。根据稳定性研究结果及其他研究数据,确认对照品的包装、保存条件、复验期(有效期);明确是否对包装进行必要的处理,如充氮、密封等;说明对照品使用时特别进行的操作,如是否需要干燥处理及处理条件、可否多次使用等。
五、如何选择残留溶剂用对照品?
Q:残留溶剂有哪些,怎么确定和分类?
A:1.具体可以参考《化学药物有机溶剂残留量研究技术指导原则》[附录] 药物中常见的残留溶剂及限度。
2.一般主要从原料药制备工艺(路线,后续溶剂和中间体)和制剂及其临床应用(剂型和给药途径,处方工艺,适应症,剂量和用药周期)来确定溶残。
3.目前大致分4类,第一类溶剂(致癌物、疑为人体致癌物或环境危害物的);第二类溶剂是指有非遗传毒性致癌(动物实验)、或可能导致其他不可逆毒性(如神经毒性或致畸性)、或可能具有其他严重的但可逆毒性的有机溶剂;第三类溶剂是GMP或其他质量要求限制使用,对人体低毒的溶剂;第四类溶剂是指在药物的生产过程中可能会使用到,但目前尚无足够的毒理学资料的溶剂。
关于对照品的选择,目前对于溶残对照并未形成普遍的共识,就当前遇到的客户对于溶残对照的认可和采购顺序做个总结:
1.药典级对照品(中检所,EP,USP等)
2.食品级(主要是食品环境类厂家包括:Dr.E,sigma,accustand,cfw,坛墨,振翔等)
3.还有医药杂质对照品厂家(TLC,QCC等)
4.最后就是一些高纯试剂(TCI,阿拉丁,百灵威,麦克林,泰坦等)
六、致突变杂质用剧毒对照品如何购买?
Q:致突变杂质用剧毒对照品如何购买?
A:1.首先致突变杂质,我们狭义理解为基因毒性杂质,在EDQM有关文献报告里面提到了30多种结构,存在基因毒性可能,其中最常见的是N-亚硝胺类和甲基磺酸酯类(明细详见文献)。
2.剧毒类对照品首先是化学品,所以应该归属到危险化学品,危险化学品有单独的采购程序,具体参照《危险化学品安全管理条例》。
3. 依法取得危险化学品安全生产许可证、危险化学品安全使用许可证、危险化学品经营许可证的企业,凭相应的许可证件购买剧毒化学品、易制爆危险化学品。
4.危险化学品生产企业、经营企业销售剧毒化学品、易制爆危险化学品,应当如实记录购买单位的名称、地址、经办人的姓名、身份证号码以及所购买的剧毒化学品、易制爆危险化学品的品种、数量、用途。销售记录以及经办人的身份证明复印件、相关许可证件复印件或者证明文件的保存期限不得少于1年。
剧毒化学品、易制爆危险化学品的销售企业、购买单位应当在销售、购买后5日内,将所销售、购买的剧毒化学品、易制爆危险化学品的品种、数量以及流向信息报所在地县级人民政府公安机关备案,并输入计算机系统。
简言之:先备案,再找有资质的企业采购,合法合规,规避风险。
七、对照品能提供质量标准并定期复检吗?
Q:对照品能否提供质量标准?
A:对于这个质量标准我们分两部分看,一是药典对照品,参考标准就是各国药典各论。第二就是一些对照品厂家提供的对照,目前来看还没有厂家能提供产品的质量标准,因为目前我们接触的这些对照品,准确的定义叫化学对照品,还不是真正意义上的标准物质,所以大部分厂家现在能做到的就是提供产品的检测方法和条件。
Q:对照品会定期复检吗?
A:会,一般的复检都是安排在产品效期截止前半年。但是目前很多我们涉及的杂质对照品,经常产品效期还没到,厂家就卖完了,所以基本上很少看到同一个批次有多个复测报告。
其次还有一个问题是有些客户采购了杂质对照品,直到效期过了都还没使用完,但是厂家已经卖完了,涉及到产品还能否继续使用的问题同时也反馈了厂家的产品稳定性研究工作的问题。
想要获取更多关于药物标准品的信息,可以关注公众号“振强标准品”,一个专注于标准品行业的振强生物!