看点:
1、36个新药申请获得临床试验默认许可,包括19个国产1类新药
2、CDE新受理44个新药(58个受理号)的临床试验申请
3、石药集团多款新药获批临床,化药、生物药全面收获
4、赛升药业 1.2 类创新型疫苗获批临床
药智数据显示,本期(7月30日至8月6日)有36个新药获批临床(54个受理号);涉及25款国产新药,11款进口新药,更多动态如下:
新药临床申请·新获批
本期,36个新药(54个受理号)获得临床试验默示许可,包括19个国产1类新药。获批临床的创新药包括TIGIT单抗、RSV单抗、CDK9)抑制剂、PD-1单抗、BCMA/CD3双抗、多款小分子化合物,适应症包括肺炎、糖尿病肾病、缓解疼痛、肝病瘙痒、带状疱疹、近视、肿瘤等。
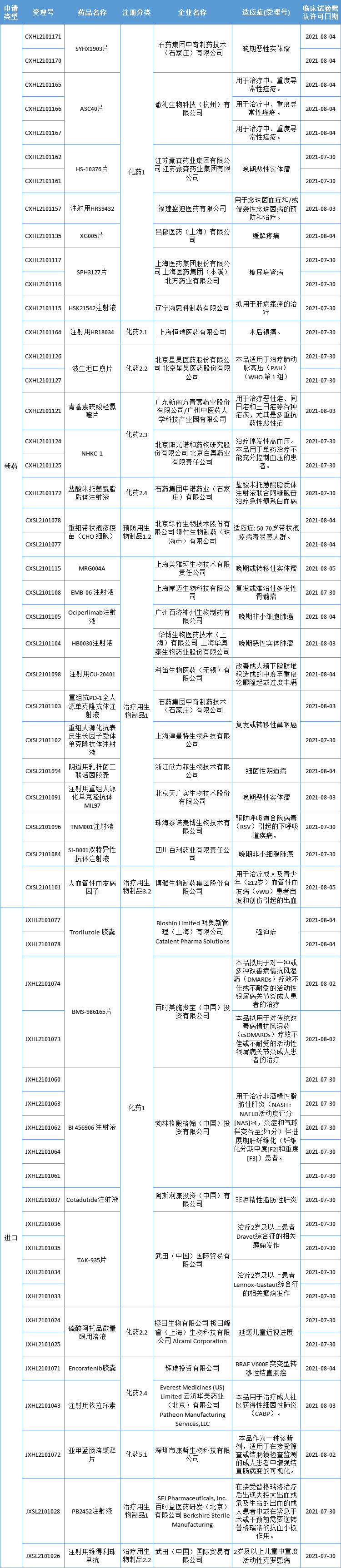
数据来源:药智数据
1.石药3款新药获批临床
SYHX1903片是一种高选择性的周期蛋白依赖的蛋白激酶9(CDK9)抑制剂,在以CDK9为靶点的恶性血液瘤和实体瘤治疗方面具有潜力。临床前研究显示,该候选药可通过高选择性抑制CDK9,对恶性血液瘤和实体瘤有良好的药效,同时具有良好的安全性和药代动力学特点。此前,SYHX1903已在中国获批开展针对恶性血液肿瘤的临床试验。本次获批临床适应症为晚期恶性实体瘤。
盐酸米托蒽醌脂质体注射液获批临床,适应症为联合阿糖胞苷治疗急性髓系白血病。不过将米托蒽醌制成脂质体制剂后,药代、组织分布、药效及毒性产生了显着的变化,有望获得更好的疗效及安全性。米托蒽醌为抗生素类化疗药,是一款广谱抗肿瘤药物,因为其不良反应,临床应用受到严重限制。
重组抗PD-1全人源单克隆抗体注射液由石药集团中奇制药研发。此前,该药已在中国获批开展针对卵巢癌的临床试验。本次获批适应症为复发或转移性鼻咽癌。
2.XG005片
XG005是昌郁医药首发产品,本次获批临床适应症为缓解疼痛。资料显示,XG005是对治疗疼痛的一线用药非甾体抗炎类药物和神经镇痛药物偶联而成。该款药物不仅能同时治疗炎性和神经并存的疼痛,同时还大大降低了两类药物单独服用或联合服用时所不可避免的胃肠道及中枢神经副作用。此外,还可以在原药所有的适应症基础上扩大适应症,以及改变给药途径,增加药物临床使用的方便性和范围。
3.SPH3127片
SPH3127是上海医药旗下1类新药,本次获批糖尿病肾病II期临床试验。SPH3127片是一种新型口服肾素抑制剂,其高血压适应证正在中国开展Ⅲ期临床试验;轻度至中度溃疡性结肠炎适应证正在美国开展II期临床试验。该药由上海医药和日本田边三菱制药株式会社合作研发,双方共同拥有知识产权。
4.HSK21542注射液
海思科子公司辽宁海思科HSK21542注射液获批开展“肝病瘙痒”的Ⅱ期临床试验。HSK21542已经完成两项健康人I期临床试验,其他已经申请的IND包括两个适应症分别为急慢性疼痛(PhaseⅢ进行中)及瘙痒适应症(PhaseⅡ进行中)。
5.重组带状疱疹疫苗(CHO 细胞)
赛升药业参股公司绿竹生物「重组带状疱疹疫苗(CHO 细胞)」获批开展预防带状疱疹的临床试验。本次获批临床的重组带状疱疹疫苗为 1.2 类创新型疫苗,是与已上市重组带 状疱疹疫苗结构不同的新抗原形式,具有免疫原性强、抗原递呈效率高和不良反应低等潜在优势。
6.MRG004A
乐普生物全资子公司上海美雅珂提交的MRG004A获批来战晚期或转移性实体瘤临床试验。据悉,MRG004A是国内第一个申报临床的靶向组织因子(tissue factor,TF)的ADC候选药物。今年2月,MRG004在美递交的新药临床试验申请已经获得FDA批准,用于针对TF阳性晚期或转移性实体瘤的I期研究。全球范围内针对TF这一靶点的在研新药项目比较稀少,在研的TF ADC药物也仅有3款,中国目前公开披露的也只有乐普生物/美雅珂一家开发靶向TF的ADC药物。
7.EMB-06 注射液
EMB-06是岸迈生物开发的一款靶向BCMA和CD3的双特异性抗体,本次获批开展复发或难治性多发性骨髓瘤临床试验。
8.Ociperlimab注射液
Ociperlimab(BGB-A1217)是一款在研人源化IgG1单克隆抗体,由百济神州自主研发并在全球范围内进行开发。本次获批临床适应症为晚期非小细胞肺癌(NSCLC)。据悉,目前尚无抗TIGIT类药物上市,罗氏开发的Tiragolumab单抗进展最快,目前正处于III期临床。 国内已有百济神州、信达生物、华海药业等 5 家公司开发的抗 TIGIT 抗体进入临床研究。
9.HB0030注射液
华海药业子公司华奥泰和华博生物申报的HB0030注射液临床试验申请获CDE批准,用于治疗晚期恶性实体肿瘤。HB0030是一款TIGIT靶向单抗,通过与TIGIT结合以阻断TIGIT与其配体(如CD155)的结合。同时,由于 HB0030 具有较强的 ADCC/CDC 活性,还可通过 ADCC/CDC 效应杀伤 Treg 细胞,进一 步解除 Treg 细胞介导的免疫抑制,增强抗肿瘤作用。
10.TNM001注射液
泰诺麦博TNM001(RSV单抗)获NMPA批准开展新药临床试验(IND),用于预防呼吸道合胞病毒(RSV)引起的下呼吸道疾病。长效全人源抗RSV中和抗体药物TNM001注射液,是泰诺麦博利用具有自主知识产权的第四代抗体技术平台HitmAb®所研发的针对RSV融合前F蛋白(Pre-F)的特异性抗体。该药物是我国首款独立自主开发的长效全人源抗呼吸道合胞病毒(RSV)中和抗体药物,也是继TNM002注射液(重组抗破伤风毒素全人源单克隆抗体)后,泰诺麦博第二个获得NMPA批准IND的全人源单克隆抗体药物。
11.硫酸阿托品微量眼用溶液
ARVN002(阿托品微量眼用溶液)是极目生物从美国Eyenovia公司引进的一款阿托品微量给药近视疗法。该药在美国三期临床试验正在进行,首例患者于2019年6月入组。本次在中国获批的儿童进展性近视三期临床试验,将评估ARVN002在儿童和青少年近视患者中控制近视进展的疗效和安全性。
12.注射用依拉环素
Xerava?是云顶新耀从Tetraphase制药公司(现为La Jolla制药公司的全资子公司)授权引进的一款新型、全合成、广谱、含氟四环素类静脉注射用抗菌药。依拉环素目前已被批准在美国和欧盟用于治疗复杂性腹腔内感染,于2020年4月在新加坡获准用于治疗成人复杂性腹腔内感染,目前在中国大陆用于治疗成人复杂性腹腔内感染的药品上市许可申请正在审理中。本次获批在中国开展3期临床试验,以评估依拉环素治疗成人社区获得性细菌性肺炎(CABP)的有效性和安全性。
新药临床申请·新受理
本期,CDE新受理44新药(58个受理号)临床申请。其中,32个品种(46个受理号)为国产新药,12个品种(12个受理号)为进口新药,更多动态如下:
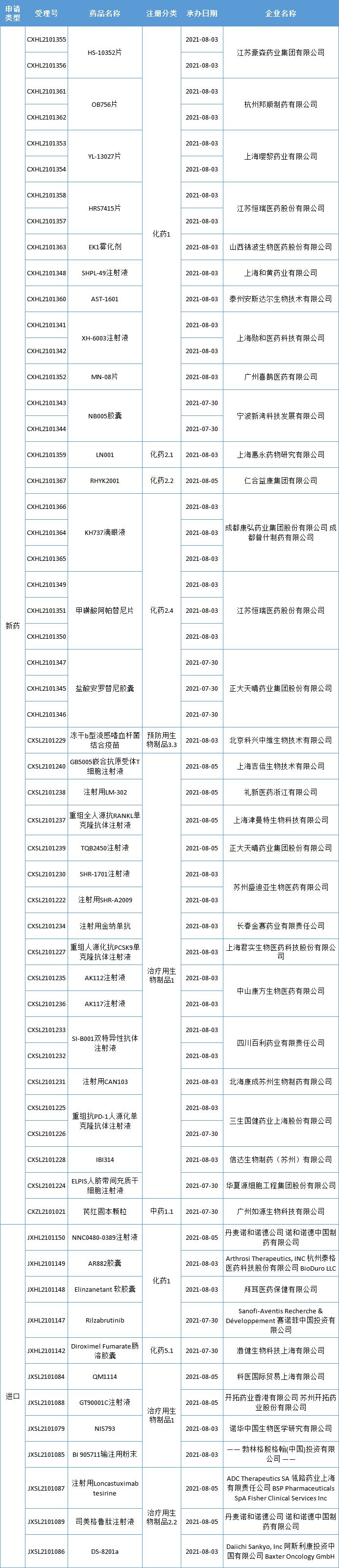
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息