本周看点
1、国内首款脑血管中成药1类新药报产!
2、四川健能制药2.2类新药「磷酸钠盐散」获批上市
3、恒瑞第二代AR抑制剂SHR3680首次申报上市
4、 一线胃癌!信达生物PD-1第7项适应症申报上市
本期(10月29日至11月5日),2类新药获批数量增长迅速,PD-1单抗适应症之争愈演愈烈,河南天方药业脑伤乐生颗粒再次报产,更多动态如下:
国内审评审批·新动态
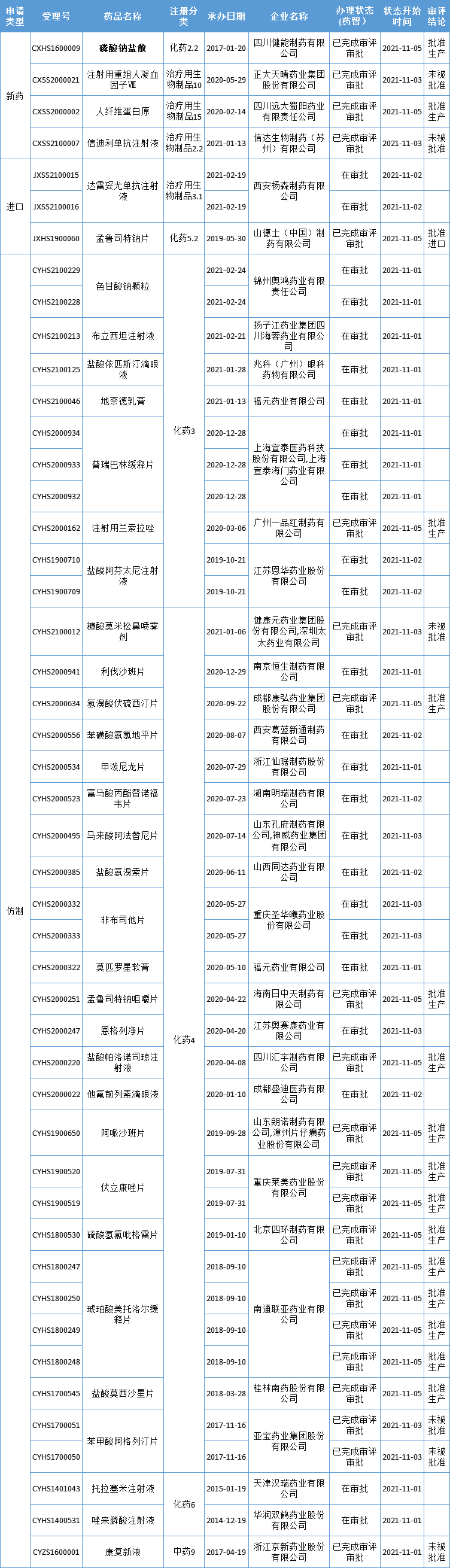
本周CDE有47个受理号(36个品种)报生产办理状态更新,其中四川健能制药的磷酸钠盐散备受关注,更多动态如下:
数据来源:药智数据
健能制药2.2类新药获批上市
四川健能制药自主研发的2.2类新药——磷酸钠盐散获NMPA批准上市。
磷酸钠盐用于患者结肠X-光线及肠道内窥镜检查或手术前清理肠道。此前,磷酸钠盐上市制剂有口服溶液,片剂。据悉,磷酸钠盐散剂是在现有磷酸钠盐制剂的基础上,加入黄原胶,其口感效果显著提高,能明显改善患者的用药依从性,增加产品配制成溶液后的溶液稳定性,而且能显著延缓产品中的磷酸二氢钠和磷酸二氢钠的在胃肠道的释放速度,改善本产品对胃肠道的不良刺激反应。
国内审评审批·新受理
本周CDE新增报生产受理号38个,共33个品种,其中恒瑞医药的SHR3680片、信达生物的信迪利单抗注射液、河南天方药业的脑伤乐生颗粒、西安杨森的利匹韦林注射液备受关注,更多动态见下表:

数据来源:药智数据
恒瑞第二代AR抑制剂SHR3680首次申报上市
近日,恒瑞医药自主研发的SHR3680片上市许可申请获国家药品监督管理局受理,拟定适应症为:高瘤负荷的转移性激素敏感性前列腺癌(mHSPC),被国家药品监督管理局药品审评中心纳入拟优先审评品种公示名单。此前,SHR3680片还被国家药品监督管理局药品审评中心纳入突破性治疗品种。
SHR3680是恒瑞医药研发的具有自主知识产权的第二代AR抑制剂,相较于第一代AR抑制剂,具有更强的AR抑制作用,且无激动作用。2018年SHR3680获得国家科技部重大新药创制课题的支持。除上述针对mHSPC的III期研究外,SHR3680片针对前列腺癌其他疾病发展阶段的II期和III期研究也正在进行中。
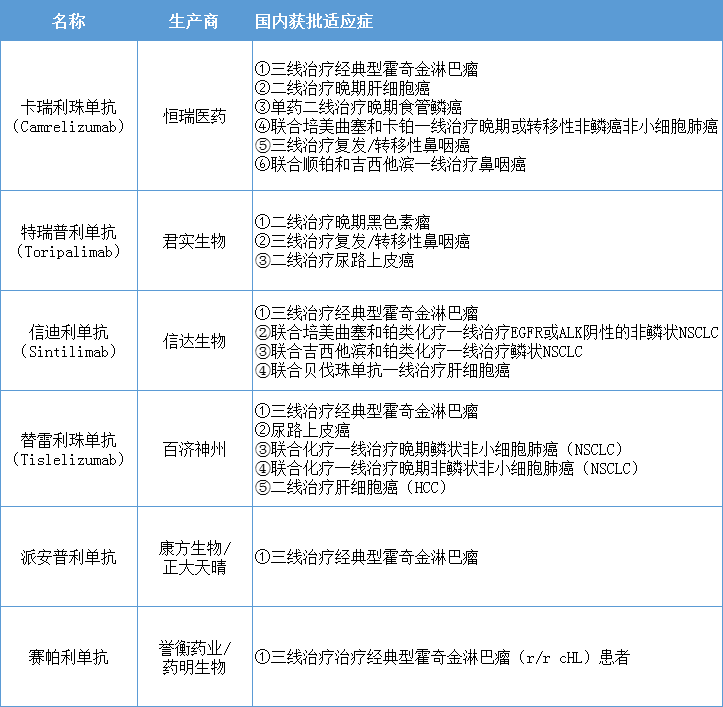
一线胃癌!信达生物PD-1第7项适应症申报上市
11月4日,信达生物的PD-1抑制剂达伯舒®(信迪利单抗注射液)联合化疗(奥沙利铂+卡培他滨)一线治疗不可切除的局部晚期、复发性或转移性胃或胃食管交界处腺癌(G/GEJ)新适应症上市申请获受理。
胃癌是全世界常见的恶性肿瘤之一,其中一半的病例发生在东亚,主要是在中国。目前在中国,仅进口 PD-1 纳武利尤单抗获批了一线胃癌适应症,信达为首家申报这一适应症的国产 PD-1。
信迪利单抗是信达生物制药和礼来制药共同合作研发的具有国际品质的创新PD-1抑制剂药物,目前已在中国获批四项适应症,包括霍奇金淋巴瘤、非鳞状NSCLC、鳞状NSCLC和肝细胞癌
此外,还有两项适应症已提交上市申请,目前处于审评审批阶段,分别是二线治疗鳞状NSCLC,联合化疗一线治疗食管鳞癌。信迪利单抗已于2019年11月成功进入中国国家医保目录,是为全国首个进入国家医保目录的PD-1抑制剂。
数据来源:药智数据
目前,国内 PD-1 竞争异常激烈。根据各药企发布的三季度财报,国内PD-1 销售额增长放缓。第三季度,信迪利单抗销售额为8亿,替雷丽珠单抗销售额4.9亿,特瑞普利单抗和卡瑞利珠单抗未披露具体销售数据,但均表示收入增长幅度有限。
强生抗HIV新药「利匹韦林注射液」在国内报产
药智数据显示,西安杨森公司提交的艾滋病新药利匹韦林注射液上市申请已获受理。此前,利匹韦林的片剂已在中国获批,与其他抗HIV药物联合使用,用于治疗成年1型人类免疫缺陷病毒(HIV-1)感染。此次杨森公司递交上市申请的是利匹韦林的注射液剂型。
据悉,利匹韦林是一种体积很小的口服非核苷逆转录酶抑制剂(NNRTI),具有疗效确切、安全性与耐受性良好的特点。除了单独用药,利匹韦林与其它HIV疗法构成的“鸡尾酒疗法”也有多款获得监管批准。例如,双药HIV疗法多替拉韦利匹韦林片、三合一HIV复方片Odefsey、长效HIV注射疗法Cabenuva等。
中药1类新药脑伤乐生颗粒申报上市!
药智数据显示,中药1.1类新药「脑伤乐生颗粒」的上市申请获得CDE承办受理,这是国内首款报产的脑血管中成药1类新药。
公开资料显示,脑伤乐生颗粒是中国医药旗下的河南天方药业与深圳市沙松实业合作研发的中药新药,具有补气养血、益脑开窍、祛瘀通络的功效,适用于治疗颅脑外伤及颅脑手术后所致的气血虚弱、脑脉受损、瘀滞经络型瘫痪等症。该药曾于2013年向国家药监局提交脑伤乐生颗粒(新药6.1类)上市申请,于2016年主动撤回,时隔五年以新药1.1类重新提交了上市申请。
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息