本周看点
1、3个中药创新药玄七健骨片、芪蛭益肾胶囊和坤心宁颗粒获批上市!
2、一周3款贝伐珠单抗生物类似药获批上市
3、百济神州罕见病新药「司妥昔单抗」正式获批
4、先声药业引进CDK4/6抑制剂「曲拉西利」申报上市
本期(11月26日至12月3日),中药创新药迎来收获期,玄七健骨片、芪蛭益肾胶囊、坤心宁颗粒3款中药创新药的上市注册申请获NMPA批准;生物类似药竞争激烈,贝达药业、东曜药业和复宏汉霖的贝伐珠单抗相继获批;百济神州罕见病新药在中国正式获批;先声药业引进CDK4/6抑制剂提交上市申请,更多动态如下:
国内审评审批·新动态
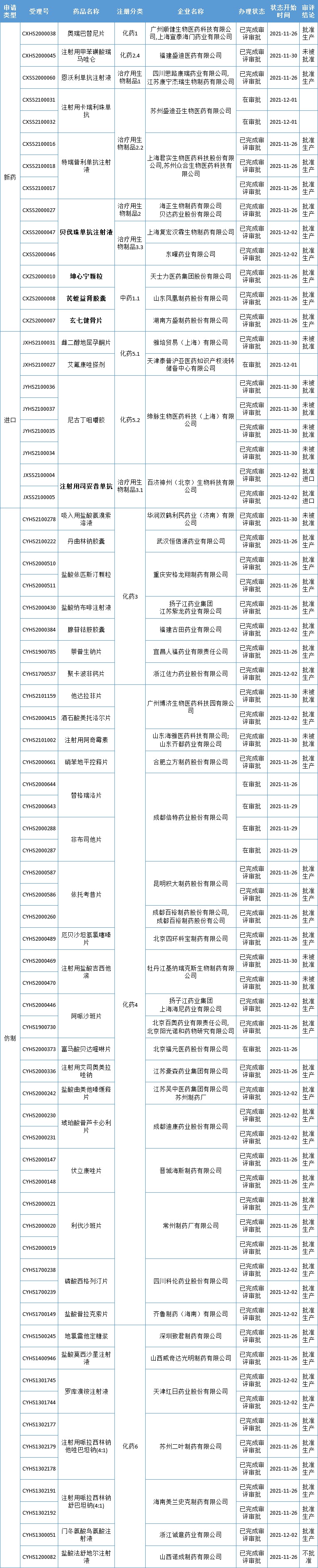
本周CDE有70个受理号(45个品种)报生产办理状态更新,其中海正生物/贝达药业、东曜药业、复宏汉霖的贝伐珠单抗注射液,百济神州的注射用司妥昔单抗,方盛制药的玄七健骨片、凤凰制药的芪蛭益肾胶囊以及天士力的坤心宁颗粒备受关注,更多动态如下:
数据来源:药智数据
3个中药创新药获批上市!
继月初,康缘药业的中药创新药银翘清热片获批上市后,本周,国家药监局又批准了3款1类中药新药,包括方盛制药的玄七健骨片、凤凰制药的芪蛭益肾胶囊和天士力的坤心宁颗粒。
国家药监局表示,上述3款中药创新药均是基于中医临床经验方基础上研制,通过开展随机、双盲、安慰剂平行对照、多中心临床试验,获得安全性、有效性证据,批准上市后将为临床相关疾病的患者提供新的治疗选择。
2021年截至目前,国家药监局在紧急批准清肺排毒颗粒、化湿败毒颗粒、宣肺败毒颗粒的基础上,又批准了6个中药新药上市。
玄七健骨片
该药上市许可持有人为湖南方盛制药股份有限公司,其临床试验研究结果显示可用于轻中度膝骨关节炎中医辨证属筋脉瘀滞证的治疗。
方盛制药采取“中药、化药、生物药”三药并举战略。其中在中药领域,方盛制药已成功开发"欣雪安"牌心脑血管科、"金蓓贝"牌儿科、"方盛堂"牌骨伤科等几大系列产品。
芪蛭益肾胶囊
该药上市许可持有人为山东凤凰制药股份有限公司,其临床试验研究结果显示可用于早期糖尿病肾病气阴两虚证的治疗。
近年来,凤凰制药开发出了具有自主知识产权的国家三类中药新药天丹通络胶囊、复方川芎胶囊、金石清热颗粒、女珍颗粒等创新药物。正在研发中药项目有芪黄胶囊。
坤心宁颗粒
坤心宁颗粒曾用名为坤怡宁颗粒,上市许可持有人为天士力医药集团股份有限公司,其临床试验研究结果显示可用于女性更年期综合征中医辨证属肾阴阳两虚证的治疗。
3款贝伐珠单抗生物类似药获批上市
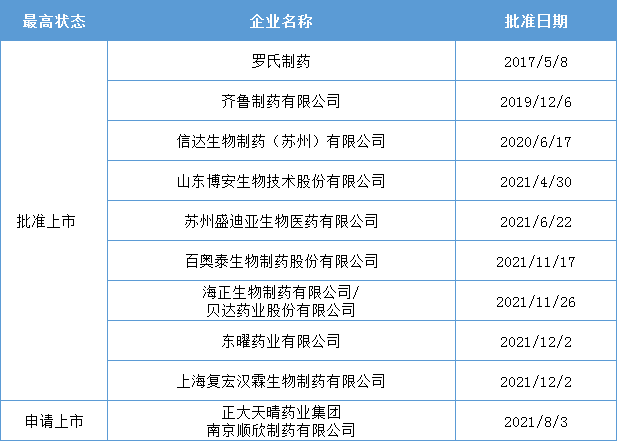
药智数据显示,本周有3款贝伐珠单抗生物类似药获批上市,来自海正生物/贝达药业、东曜药业、复宏汉霖。
贝伐珠单抗是一款抗血管内皮细胞生长因子单克隆抗体(抗VEGF mAb)。原研安维汀2004年2月首次获FDA批准上市,目前已在全球已经获批多个适应症,在我国获批6个适应症,分别是:转移性结直肠癌(mCRC)、非小细胞肺癌(NSCLC)、胶质母细胞瘤(GBM)、肝细胞癌(HCC)、卵巢癌(OC)、宫颈癌(CC)。
药智数据显示,除罗氏的贝伐珠单抗原研外,还有8款贝伐珠单抗生物类似药在中国获批上市,分别是齐鲁制药、信达生物、恒瑞医药、博安生物、百奥泰、海正生物/贝达生物、东曜药业和复宏汉霖。此外,正大天晴也已经递交上市申请。
数据来源:药智数据
海正生物/贝达药业申报的贝伐珠单抗注射液MIL60获批适应症为:转移性结直肠癌和晚期、转移性或复发性非小细胞肺癌。2017年2月,贝达药业与北京天广实生物技术股份有限公司就贝伐珠单抗注射液项目达成合作,受托生产企业为博锐生物下属子公司海正生物制药有限公司。
东曜药业发申报的贝伐珠单抗注射液TAB008获批适应症为:治疗晚期、转移性或者复发性非鳞状非小细胞肺癌和转移性结直肠癌。这是是东曜药业首个获批上市的抗体药。
复宏汉霖申报的贝伐珠单抗生物类似药HLX04获批适应症为:晚期、转移性或复发性非小细胞肺癌以及转移性结直肠癌患者的治疗。据悉,复宏汉霖还与亿胜生物签订全球许可协议,共同开发HLX04眼科适应症,合作金额超4300万美元。
百济神州引进的罕见病新药「司妥昔单抗」正式获批
12月2日,国家药品监督管理局通过优先审评审批程序批准临床急需罕见病药品注射用司妥昔单抗(英文名: Siltuximab for Injection)的进口注册申请,用于人体免疫缺陷病毒(HIV)阴性和人疱疹病毒8型(HHV-8)阴性的多中心卡斯特曼病(MCD)成人患者。
司妥昔单抗是一种人-鼠嵌合单克隆抗体,可阻断人白细胞介素-6(IL-6)与IL-6受体相结合,对IL-6产生抑制作用,继而抑制细胞生长。该品种的上市为患者提供了治疗选择。司妥昔单抗自2014年首次获批以来,已在全球40多个国家和地区获得批准用于治疗人类免疫缺陷病毒(HIV)阴性、人类疱疹病毒8(HHV-8)阴性的多中心型Castleman病患者。
在中国,司妥昔单抗曾因罕见病用药被纳入《第一批临床急需境外新药》名单。
2020年1月,百济神州与EUSA Pharma达成合作,获得了司妥昔单抗以及另外一款抗体药物在大中华地区开发和商业化权利。另一款药物为达妥昔单抗β(dinutuximab beta),已于今年8月在中国获批上市,用于治疗12月龄及以上的高危神经母细胞瘤患者。
国内审评审批·新受理
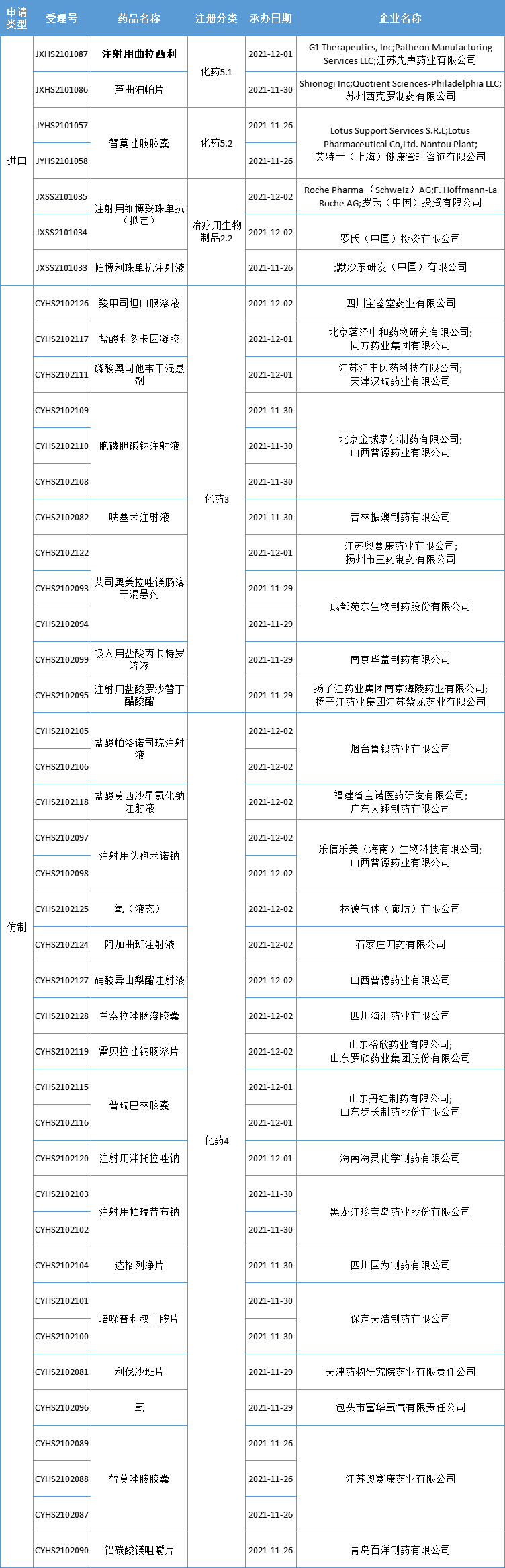
本周CDE新增报生产受理号43个,共29个品种,其中先声药业的注射用曲拉西利备受关注,更多动态见下表:
数据来源:药智数据
先声药业引进CDK4/6抑制剂「曲拉西利」上市申请获受理
近日,先声药业向国家药品监督管理局递交的骨髓保护创新药注射用曲拉西利(Trilaciclib)上市许可申请(NDA)获受理,本次申请适应症为:在接受含铂类药物联合依托泊苷方案的广泛期小细胞肺癌患者中预防性使用,以降低化疗引起的骨髓抑制的发生率。
曲拉西利是G1 Therapeutics公司开发的一款短效CDK 4/6抑制剂,曾被美国FDA授予突破性治疗认定和优先审评资格。该药已于今年2月在美国上市,用于降低广泛期小细胞肺癌患者在接受某些类型化疗时出现的骨髓抑制频率。
除小细胞肺癌外,G1公司还启动了曲拉西利在三阴性乳腺癌及转移性结直肠癌(mCRC)的Ⅲ期临床试验,关于乳腺癌新辅助化疗、非小细胞肺癌二线治疗以及膀胱癌一线治疗的探索性研究也在境外进行中。
2020年8月,G1公司与先声药业达成达1.7亿美元的独家许可协议,先声药业获得这款创新疗法在大中华地区所有适应症的开发和商业化权益。目前正在开展曲拉西利在小细胞肺癌、结直肠癌、三阴性乳腺癌三项适应症的III期临床试验。
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息