本期(6月17日至6月24日),国产PD-1竞争异常激烈,信达生物信迪利单抗连获两项一线适应症,赶上今年医保谈判末班车,百济神州PD-1已申报10项适应症,正大天晴、石药集团1类新药来袭,更多动态如下:
国内审评审批·新动态
本期CDE有53个受理号(36个品种)报生产办理状态更新,其中信达生物的信迪利单抗注射液和欧康维视的氟轻松玻璃体内植入剂备受关注。更多动态如下:
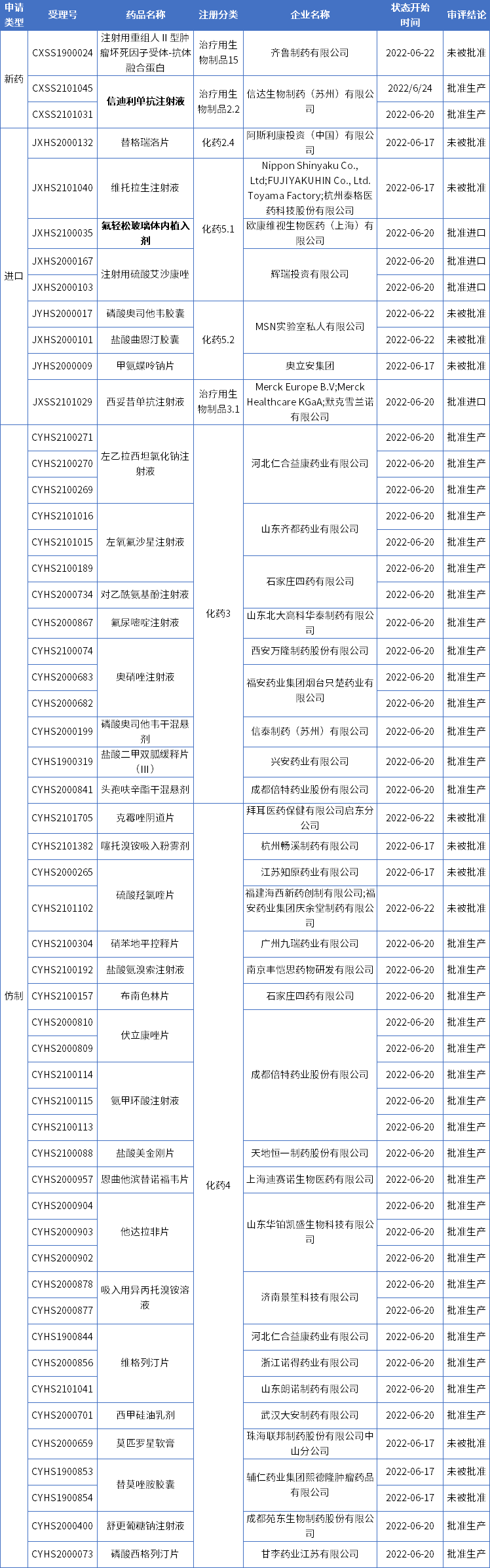
数据来源:药智数据
信达生物PD-1单抗获批两项一线适应症
近日,信达生物和礼来共同开发的信迪利单抗注射液获NMPA批准两项新适应症:
1. 联合紫杉醇和顺铂或氟尿嘧啶和顺铂一线治疗不可切除的局部晚期、复发或转移性食管鳞癌。
2. 联合化疗(奥沙利铂+卡培他滨)一线治疗不可切除的局部晚期、复发性或转移性胃或胃食管交界处腺癌(G/GEJ)。
这两项适应症都有望在今年下半年参加医保谈判,快速进入医保目录。
国产PD-1单抗获批适应性情况
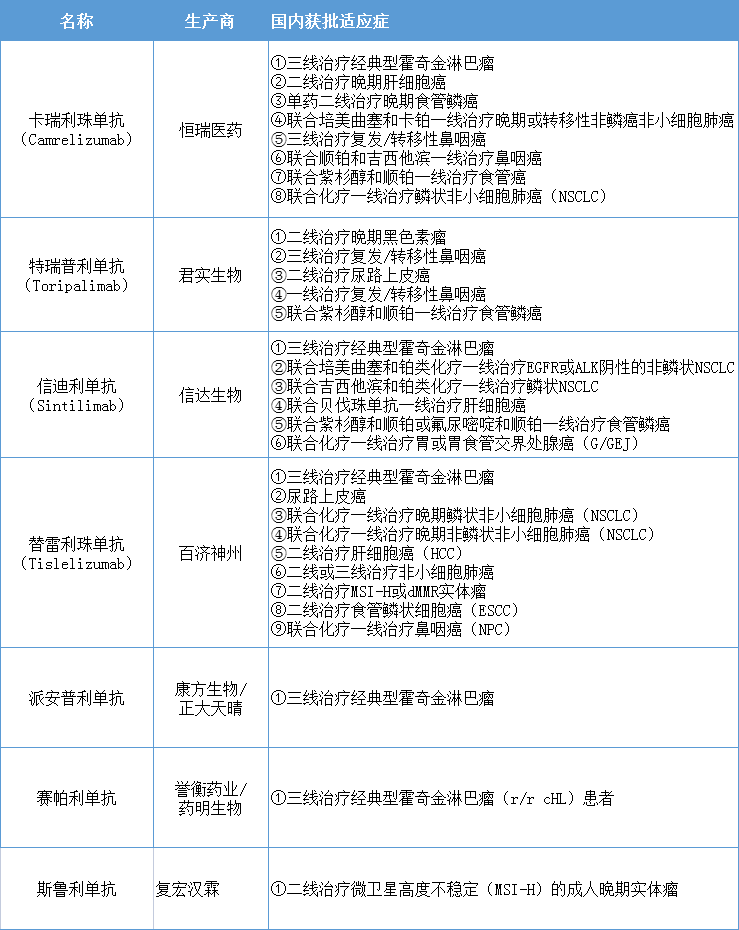
数据来源:药智数据
欧康维视引进first in class眼科新药在国内获批
药智数据显示,欧康维视引进的OT-401(氟轻松玻璃体植入剂,商品名:优施莹)上市申请已获NMPA批准,用于治疗累及眼后段的慢性非感染性葡萄膜炎(慢性NIU-PS)。据悉,这是欧康维视管线中第一款获批上市的新药。

2018年11月,欧康维视将OT-401引入中国,并在海南博鳌超级医院启动真实世界研究。2021年4月,欧康维视基于真实世界研究数据提交了OT-401的新药上市申请。
研究数据显示,在中国真实世界诊疗环境中,OT-401能够显著降低患者葡萄膜炎复发率,显著提高视力,植入OT-401的患者全身系统性用药、眼局部激素用量明显下降,黄斑水肿明显缓解。整个随访期间安全性良好,未发生非预期的严重的不良事件。
OT-401本次在国内获批,填补了国内葡萄膜炎治疗领域的空白。
国内审评审批·新受理
本期CDE新增报生产受理号44个,共34个品种,其中正大天晴的TQ-B3101胶囊、上海津曼特生物的纳乐舒单抗注射液、以及百济神州的替雷利珠单抗注射液备受关注,更多动态见下表:

数据来源:药智数据
正大天晴1类新药TQ-B3101胶囊申报上市
6 月 23 日,正大天晴 1 类新药TQ-B3101 上市申请获得CDE受理。据悉,这是一款 ALK/MET/ROS1 抑制剂,适应症预计为:ROS1 融合阳性晚期 NSCLC。
值得一提的是,今年 5 月 20 日,正大天晴也申报了一款 c-Met/ALK/ROS 多靶点酪氨酸激酶抑制剂 TQ-B3139,用于 ALK 阳性 NSCLC。相隔一个月,正大天晴又申报了第二款肿瘤新药。可见正大天晴的新药开发已经进入收获期。
TQ-B3101 和 TQ-B3139 靶点虽然相似,但其开发路线又有差异化。前者核心发力方向在 ROS1 阳性实体瘤,后者则偏重于对 ALK 阳性患者群体的治疗。
此外,正大天晴处于后期临床阶段的新药还有3代EGFR TKI、CDK4/6抑制剂、PD-L1抗体等。
石药 1 类新药 RANKL 单抗报上市
6 月 22 日,NMPA受理了石药集团子公司津曼特生物提交的 1 类新药纳乐舒单抗注射液(JMT103 )的上市申请,适应症为治疗不可切除或手术困难的骨巨细胞瘤。同时石药集团还申请了优先审评,目前还在进行中。

百济神州PD-1申报第10项适应症
6月22日,NMPA受理了百济神州申报的替雷利珠单抗(商品名:百泽安)联合化疗,用于一线治疗肿瘤表达PD-L1的晚期或转移性胃或胃食管结合部(G/GEJ)腺癌患者的新适应症上市申请。这是替雷利珠单抗在中国递交的第10项上市许可申请,此前该药已有9项适应症获获NMPA批准。
近年来,国产PD-1相继获批,目前已有7款获批上市,适应症争夺战异常激烈。百济神州的替雷利珠单抗是获批适应症最多的一款,已在国内获批9项适应症,涵盖非小细胞肺癌(NSCLC)、经典型霍奇金淋巴瘤、尿路上皮癌、肝细胞癌、食管鳞状细胞癌、鼻咽癌等等。
本次申报的胃或胃食管结合部(G/GEJ)腺癌适应症仅信达生物获批,百济神州如今报产有望成为国产第 2 款用于这一适应症的 PD-1 单抗。
 、企业公告等网络公开数据
、企业公告等网络公开数据
 、企业公告等网络公开信息
、企业公告等网络公开信息