看点:
1、37项新药申请获得临床试验默认许可,包括19款1类新药
2、CDE新受理30个新药(53个受理号)的临床试验申请
3、礼来重磅降糖药Tirzepatide减肥适应症在国内获批临床
4、两款干细胞疗法进入临床阶段
药智数据显示,本期(9月9日至9月16日)有37项新药申请获得临床试验默认许可,涉及13款国产新药,10款进口新药;另有30个品种(53个受理号)临床申请获CDE承办受理,更多动态如下:
新药临床申请·新获批
本期,37项新药申请获得临床试验默认许可,涉及13款国产新药,10款进口新药。获批临床的创新药涉及多款小分子创新药、单抗、双抗、融合蛋白、干细胞疗法等,适应症涵盖多种肿瘤、疼痛、黄斑变性、细菌感染、心肌梗死、脑卒中、自身免疫性疾病、血友病、帕金森病、肥胖等。
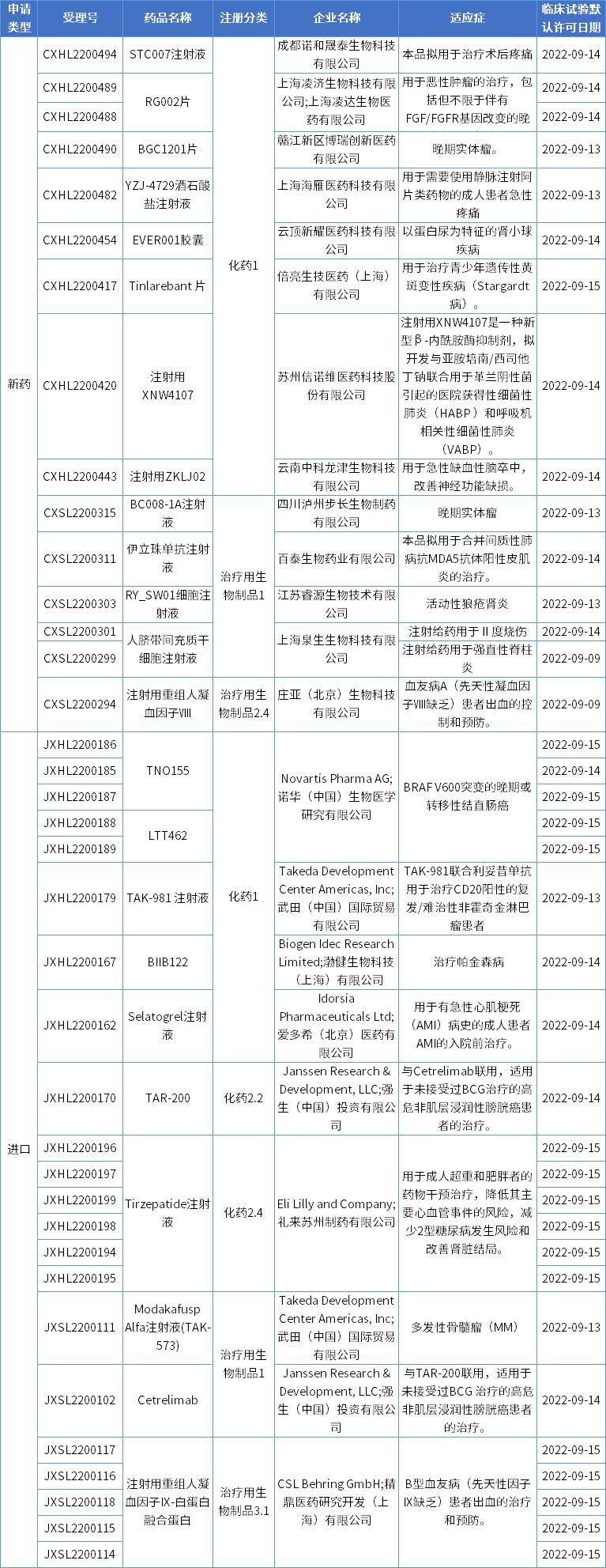
数据来源:药智数据
1.STC007注射液
该药是阳光诺和子公司诺和晟泰通过应用计算机辅助药物分子设计(CADD)与经验分子结构改造(SAR)相结合手段,开发的一款化学1类新药,拟用于治疗术后疼痛。 STC007注射液对κ阿片样物质(KOR)受体具有较强结合力,且在3种啮齿类动物疼痛模型中表现出良好的镇痛效果,毒理学研究中未见明显的不良反应,展现了良好的成药性和安全性,且无明显成瘾性风险。
2.RG002片
该药是凌济生物开发的新一代抗肝胆肿瘤耐药新药泛FGFR1-4 不可逆抑制剂,拟用于恶性肿瘤的治疗,包括但不限于伴有FGF/FGFR基因改变的晚期胆管癌、肝细胞癌、尿路上皮癌等。
3.BGC1201片
该药是博瑞医药开发的一款小分子创新药,拟用于晚期实体瘤的治疗。此次为该项目首次获批临床。据悉,BGC1201是 RTK-RAS-MAPK 信号通路靶向药物,兼具靶向肿瘤生长和肿瘤免疫的双重机制,BGC1201对 RAS-ERK 信号通路有调控作用,在调节肿瘤细胞存活和生长中发挥重要作用。此外,BGC1201作用位点处于PD1等免疫检查点下游,介导肿瘤免疫逃逸信号。
4.YZJ-4729酒石酸盐注射液
该药是扬子江药业全资子公司上海海雁医药开发的一款1类小分子创新药,靶点未知,本次获批临床,拟用于需要使用静脉注射阿片类药物的成人患者急性疼痛。药智数据显示,目前海雁医药申报临床1类新药已有7款,包括YZJ-0318 马来酸盐片、YZJ-0673马来酸盐片、YZJ-1495盐酸盐胶囊、YZJ-2440马来酸盐片、YZJ-3058片、YZJ-5053片以及YZJ-4729酒石酸盐注射液。
5.EVER001胶囊
EVER001(又名XNW1011)是信诺维自主研发的新一代共价可逆的BTK抑制剂。2021年9月,信诺维、中国抗体制药与云顶新耀宣布达成全球独家合作协议,将XNW1011(SN1011)全球范围的肾脏疾病领域开发和商业化的权利授权给云顶新耀。本次EVER001胶囊获批临床适应症为以蛋白尿为特征的肾小球疾病。
6.Tinlarebant 片
Tinlarebant (LBS-008) 是倍亮生技的主要候选产品,是一种口服的非维甲酸类 RBP4 小分子拮抗剂,每日口服一次,可以减少和维持维生素A(视黄醇)向眼睛的输送,以减少有毒维生素A副产物在眼组织中的积累。LBS-008曾获得FDA授予孤儿药认证(ODD)、儿科罕见疾病认证(RPD),快速审查认定,以及欧盟EMA授予的ODD。本次Tinlarebant在国内获批开展临床试验,用于治疗青少年遗传性黄斑变性疾病(Stargardt 病)。
7.注射用XNW4107
该药是信诺维医药开发的新一代β-内酰胺酶类广谱抗耐药菌药物,专门针对细菌耐药挑战而设计。本次批准开展3期临床,拟开发与亚胺培南/西司他丁钠联合用于革兰阴性菌引起的医院获得性细菌性肺炎(HABP)和呼吸机相关性细菌性肺炎(VABP)。值得一提的是,今年4月该3期临床方案也已获得美国FDA批准。此前XNW4107还曾获得FDA授予的合格传染病产品资格(QIDP)和快速通道资格。
8.注射用ZKLJ02
该药是龙津药业开发的一款化学1类创新药,本次获批临床,用于急性缺血性脑卒中, 改善神经功能缺损。
9.BC008-1A注射液
该药是步长制药开发的一款特异性靶向 PD-1 和 TIGIT 的双抗药物,目前国内外尚无同类双靶点药物批准上市。本次获得临床试验默示许可,适应症为晚期实体瘤。这是继HER2/CD3双抗注射液BC004后,步长制药今年第二款步入临床阶段的创新生物药。
10.伊立珠单抗注射液
伊立珠单抗(Itolizumab)是由Biocon Biopharmaceuticals开发的一款全球首创CD6单克隆抗体药物。该药已于2013年在印度获批上市,并先后于2013年和2020年获批银屑病和新冠病毒适应症。百泰生物目前已提交3项针对伊立珠单抗的临床申请,均获得临床默认许可,适应症分别为:急性移植物抗宿主病、病毒性肺炎引发的中重度急性呼吸窘迫综合征、合并间质性肺病抗MDA5抗体阳性皮肌炎。
11.RY_SW01细胞注射液
该药是由睿源生物申报的一款异体间充质干细胞药物,拟开发治疗活动性狼疮肾炎。今年6月,睿源生物与江苏省人民医院合作的“注射用人脐带间充质干细胞(hUC-MSCs)治疗难治性狼疮肾炎的安全性、耐受性、疗效探索的单中心临床研究”临床试验已在江苏省人民医院完成首例受试患者给药入组,初步结果显示,RY_SW01细胞注射液具有良好的安全性。
12.人脐带间充质干细胞注射液
该药是上海泉生生物开发的一款人脐带间充质干细胞产品,研发代号ASCP04。目前已有3项适应症获得临床默认许可,分别为,轻至中度急性呼吸窘迫综合征(ARDS),强直性脊柱炎,Ⅱ度烧伤,还有一项临床试验申请尚在审评审批中。
13.TNO155
该药是诺华开发的一款First-in-class选择性、变构、口服SHP2抑制剂,同时也是首个进入临床的SHP2抑制剂,是在高通量筛选出的先导化合物SHP836的基础上,进一步优化得到的,具有理想的成药性,例如:高渗透性、高溶解度、不抑制CYP450、理想的临床前PK参数。本次TNO155在国内获批临床,拟用于晚期实体瘤。
14.LTT462
该药是诺华开发的一款ERK激酶抑制剂,目前全球尚无ERK激酶抑制剂获批上市,进展较快的项目包括BioMed Valley Discoveries开发的优立替尼、礼来开发的LY3214996、诺华开发的LTT462。
15.TAK-981 注射液
TAK-981注射液(subasumstat)是武田制药开发的一款类泛素蛋白修饰小分子(SUMO)抑制剂。目前,TAK-981正在多种实体瘤和血液肿瘤中开展1/2期临床研究。在中国,该药曾获批在转移性或局部晚期实体肿瘤和血液系统恶性肿瘤成年患者中开展临床研究。本次该药获批临床的适应症为:联合利妥昔单抗用于治疗CD20阳性的复发/难治性非霍奇金淋巴瘤患者。
16.BIIB122
BIIB122 (DNL151) 是一款潜在first-in-class的LRRK2小分子抑制剂,目前正在海外开展治疗帕金森病的3期临床试验。2020年,渤健与Denali Therapeutics达成一项超10亿美元的合作,从而获得合作开发和共同商业化BIIB122的权益。本次BIIB122在国内获批临床,适应症为用于治疗帕金森病。
17.Selatogrel注射液
该药是一种高效、高选择性、可逆的P2Y12受体拮抗剂,起效快,作用时间短。本在国内获得临床默认许可,拟用于有急性心肌梗死(AMI)病史的成人患者AMI的入院前治疗。
18.TAR-200
该药由TARIS公司专有的膀胱癌新型靶向药物递送技术“TARIS技术”开发,可在膀胱内持续数周连续释放化疗药物吉西他滨。在美国,FDA已授予TAR-200快速通道资格,用于治疗不适合根治性疗法的肌肉浸润性膀胱癌(MIBC)患者。2019年12月,强生收购TARIS,将TAR-200收入囊中。本次TAR-200在中国获批开展临床试验,与强生的PD-1单抗Cetrelimab联用,适用于未接受过BCG治疗的高危非肌层浸润性膀胱癌患者的治疗。
19.Tirzepatide注射液
替尔泊肽(Tirzepatide)是一款GIP/GLP-1受体双重激动剂,是一款First-in-class药物,于2022年5月首次获FDA批准上市,用于治疗2型糖尿病。在中国,Tirzepatide注射液2型糖尿病适应症上市申请已于本月早些时候获得CDE受理。本次Tirzepatide注射液新适应症在国内获批临床,用于成人超重和肥胖者的药物干预治疗,降低其主要心血管事件的风险,减少2型糖尿病发生风险和改善肾脏结局。
20.Modakafusp Alfa注射液 (TAK-573)
TAK-573是武田制药与梯瓦(Teva)合作开发的一款潜在First-in-class免疫靶向减毒细胞因子。据悉,TAK-573不但能够直接杀死癌细胞,而且能够激活CD8阳性T细胞。此外,CD38的特异性和干扰素α2b分子与受体结合亲和力的减弱,显著降低了该产品脱靶结合风险和发生毒性的可能性。本次获批在国内开展多发性骨髓瘤(MM)适应症临床试验。
新药临床申请·新受理
本期,CDE新受理30新药(53个受理号)临床申请。其中,23个品种(39个受理号)为国产新药,7个品种(14个受理号)为进口新药,更多动态如下:
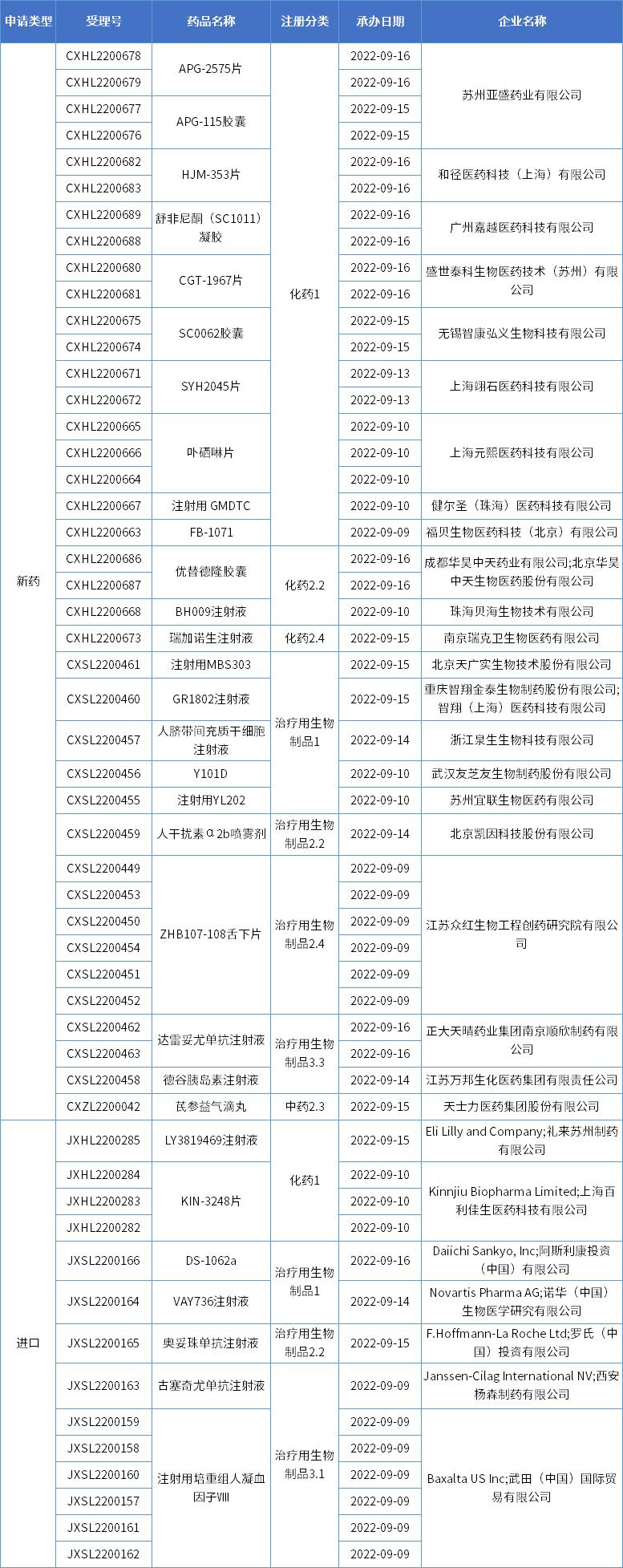
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息