本周看点
1、华领医药First-in-class 降糖新药获批上市
2、化药2类新药大爆发!5款获批上市
3、两款中药1类新药申报上市!
4、恒瑞两款新药申报上市
本期(10月7日至10月14日),化药2类新药大爆发!5款获批上市;历经十年,华领医药First-in-class 降糖新药多扎格列艾汀片终于获批上市;两款中药1类新药申报上市,均来自四川药企,更多动态如下:
国内审评审批·新动态
本期CDE有88个受理号(64个品种)报生产办理状态更新,其中华领医药的多扎格列艾汀片,以及2类新药兰索拉唑碳酸氢钠胶囊、注射用左亚叶酸钠、艾司奥美拉唑镁碳酸氢钠胶囊、环泊酚注射液、妥布霉素吸入溶液备受关注。更多动态如下:
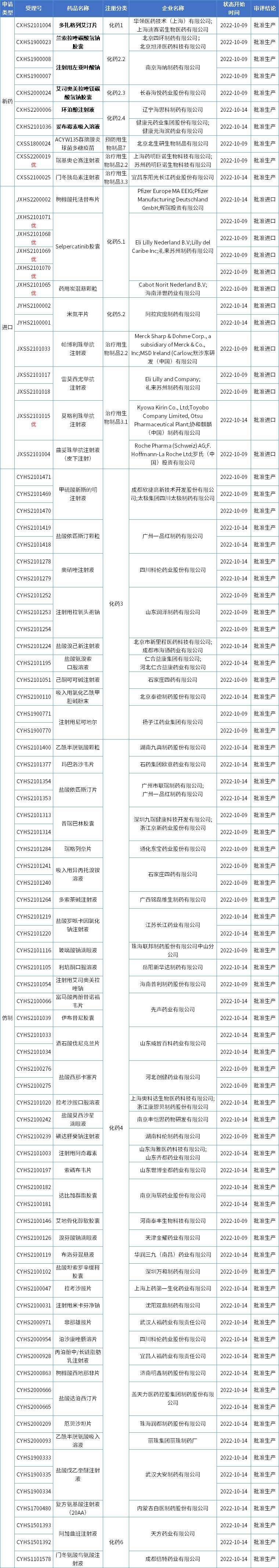
数据来源:药智数据
华领医药First-in-class 降糖新药获批上市
多扎格列艾汀是华领医药开发的一款拥有全新机制、中国首批的“first-in-class”新药,属于葡萄糖激酶(GK)激活剂,作用于胰岛、肠道内分泌细胞以及肝脏等葡萄糖储存与输出器官中的葡萄糖激酶靶点,改善2型糖尿病患者血糖稳态失调。
多格列艾汀片(商品名:华堂宁)获NMPA批准,用于改善成人2型糖尿病患者的血糖控制。目前,华领医药已与合全药业签订有关多格列艾汀片商业化生产合作协议。另外,早在2020年8月,华领医药与拜耳达成合作,拜耳获得该产品在中国独家商业化的权利,华领医药将获得3亿元人民币的预付款,此外其还将获得额外最高可达到41.8亿元人民币的里程碑付款。
化药2类新药大爆发!5款获批上市
根据2020版化药注册分类(2020年7月1日起实施),2类新药指境内外均未上市的改良型新药,包括:
2.1类:含有用拆分或者合成等方法制得的已知活性成份的光学异构体,或者对已知活性成份成酯,或者对已知活性成份成盐(包括含有氢键或配位键的盐),或者改变已知盐类活性成份的酸根、碱基或金属元素,或者形成其他非共价键衍生物(如络合物、螯合物或包合物),且具有明显临床优势的药品。
2.2类:含有已知活性成份的新剂型(包括新的给药系统)、新处方工艺、新给药途径,且具有明显临床优势的药品。
2.3类:含有已知活性成份的新复方制剂,且具有明显临床优势。
2.4类:含有已知活性成份的新适应症的药品。
兰索拉唑碳酸氢钠胶囊
北京四环制药以新药2.2类提交的兰索拉唑碳酸氢钠胶囊上市申请已获NMPA批准。兰索拉唑是新型的质子泵抑制剂(PPI),对基础胃酸和所有刺激物所致的胃酸分泌均有明显的抑制作用。此外,厦门恩成制药的兰索拉唑碳酸氢钠胶囊也已申报上市。
注射用左亚叶酸钠
南京海纳制药以新药2.2类提交的注射用左亚叶酸钠上市申请已获NMPA批准。左亚叶酸是亚叶酸的活性成分,是多种癌症联合化疗药物中使用最广泛的化疗辅助药物。目前中国已有多家公司的注射用左亚叶酸钙获批上市,而注射用左亚叶酸钠是一种新剂型,不过在去年7月,汇伦医药子公司上海汇伦江苏药业申报的注射用左亚叶酸钠已抢先获批,南京海纳制药是第二家获批的注射用左亚叶酸钠。
艾司奥美拉唑镁碳酸氢钠胶囊
长春海悦药业以新药2.3类提交的艾司奥美拉唑镁碳酸氢钠胶囊上市申请已获NMPA批准。该药为化学复方制剂,用于治疗胃食管反流病;与适当的抗菌疗法联合用药根除幽门螺杆菌。
环泊酚注射液
环泊酚注射液(HSK3486乳状注射液)是海思科研发的一款全新具有自主知识产权的静脉麻醉药物,其活性成分环泊酚是(R)-构型异构体小分子药物,为GABAA受体激动剂。2020年12月,环泊酚注射液首次在中国获批,用于消化道内镜检查中的镇静,此后又相继获批用于全身麻醉诱导、支气管镜检查中的镇静、全身麻醉诱导和维持、重症监护期间的镇静,本次获批新适应症:妇科门诊手术的镇静及麻醉。
妥布霉素吸入溶液
妥布霉素是一种临床耐药性较少的氨基糖苷类抗生素,是用作肺部铜绿假单胞菌早期感染的一线治疗药物。妥布霉素吸入溶液最早由 PathoGenesis 公司(2001 年被 Novartis 收购)开发,于1997 年12 月被FDA 批准上市。健康元的妥布霉素吸入溶液是针对我国支气管扩张症的高发病率和临床药物匮乏的现状而研制出来的抗菌药物新型吸入制剂,是国内首款获批上市的吸入抗生素类药物。
国内审评审批·新受理
本期CDE新增报生产受理号85个,共65个品种,其中中药1类新药拈痛祛风颗粒、风叶咳喘平口服液,和恒瑞医药的盐酸右美托咪定鼻喷雾剂、马来酸吡咯替尼片备受关注,更多动态见下表:
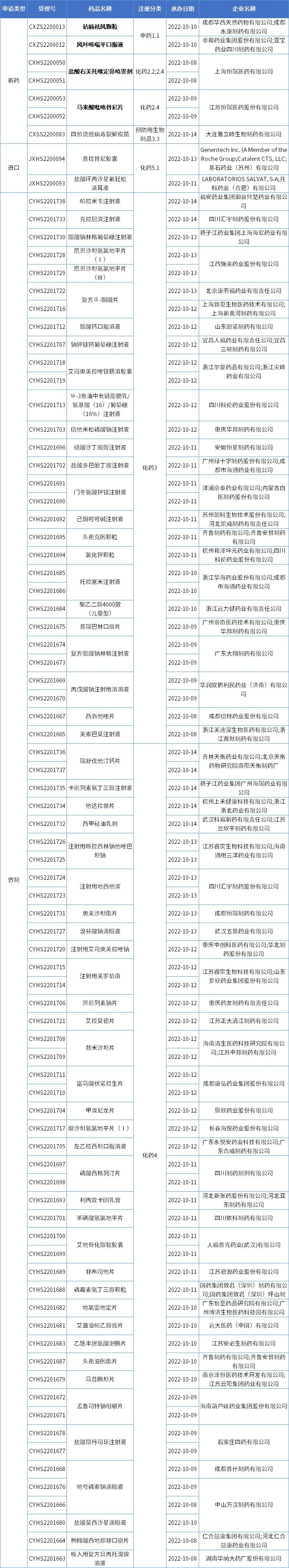
数据来源:药智数据
两款中药1类新药申报上市!
自2020版中药注册分类(2020年7月1日起实施)实施以来,已有多款1类中药创新药申报上市,其中9款已获批上市,8款还在审评审批中。
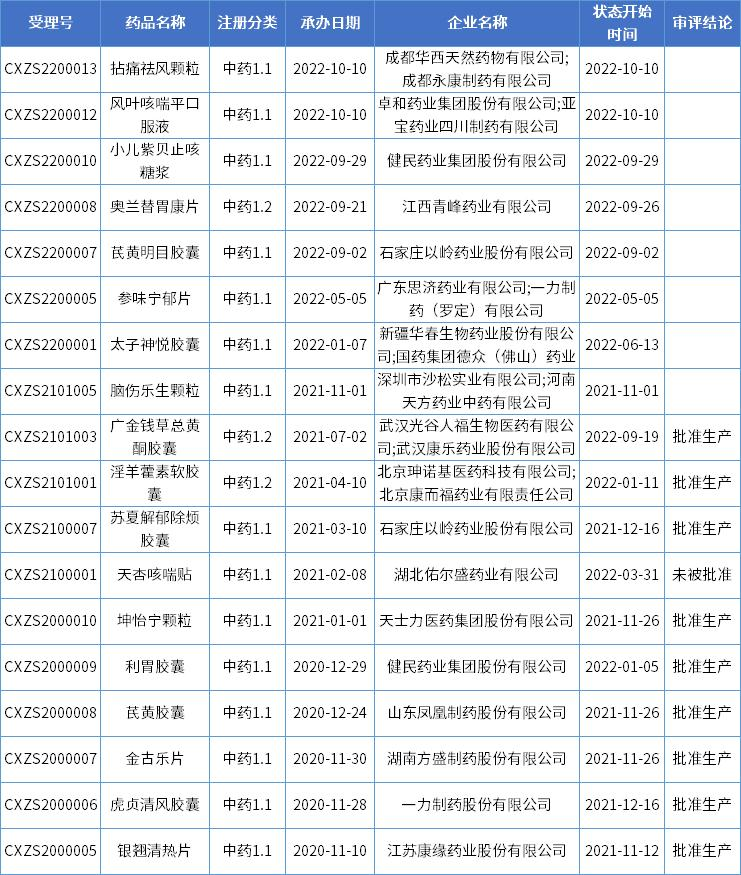
数据来源:药智数据
拈痛祛风颗粒
该药是成都华西天然药物有限公司与成都永康制药有限公司开发的一款中药1.1类创新药,具有清热利湿、祛风止痛的功效,适用于急性痛风性关节炎(风湿郁热证)。
风叶咳喘平口服液
该药由卓和药业集团股份有限公司与亚宝药业四川制药有限公司开发,可用于治疗急性支气管炎咳嗽。
恒瑞两款新药申报上市
本周恒瑞医药两款创新药提交了新适应症的上市申请。
盐酸右美托咪定鼻喷雾剂
盐酸右美托咪定是一款α2-肾上腺素能受体激动剂,具有中枢性抗交感和抗焦虑作用,能产生近似自然睡眠的镇静作用。目前,市场上的盐酸右美托咪定剂型主要为盐酸右美托咪定氯化钠输液和盐酸右美托咪定注射液两种。
恒瑞提交的盐酸右美托咪定鼻喷雾剂为一种新剂型,相比注射剂,具有利用度高、给药方便等优点。根据CDE公示,盐酸右美托米啶鼻喷雾剂的上市申请已纳入优先审评,用于儿童术前镇静(如儿童全身麻醉)。
马来酸吡咯替尼片
马来酸吡咯替尼江苏恒瑞医药开发的一款1类创新药,是一种小分子、不可逆、泛ErbB受体酪氨酸激酶抑制剂。该药曾在2018年凭借II期临床研究数据获附条件批准上市,随后于2019年被纳入国家医保,2020年,吡咯替尼凭借两项重要III期研究(PHENIX、PHOEBE)结果获得国家药监局完全批准上市,联合卡培他滨用于HER2阳性、接受过曲妥珠单抗的复发或转移性乳腺癌患者的治疗。2022年5月,吡咯替尼获批第二个适应症,与曲妥珠单抗和多西他赛联合,用于HER2阳性早期或局部晚期乳腺癌患者的新辅助治疗。
本次恒瑞提交了马来酸吡咯替尼片新适应症的上市许可申请,拟定适应症为与曲妥珠单抗和多西他赛联合,用于治疗表皮生长因子受体2(HER2)阳性、晚期阶段未接受过抗HER2治疗的复发或转移性乳腺癌患者。
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息