看点:
2021上半年药审中心受理总量为5155个。
化药1类新药申报远超2020年同期,申报增长量达88%。
中药申报量大幅上升,今年上半年申报量达2020年全量的84.96%。
好的药品为我们的健康保驾护航,给饱受病痛折磨的人们带去新的希望;截止至2021年6月30日,CDE审评中心受理5155个受理号,申报临床和生产的比去年同期明显增加,申报临床的有1162个受理号,申报生产的有1818个受理号。以下为详细的上半年受理情况分析:
一、2021上半年,药品注册申请受理总体情况
1、各药品类型申报情况
2021年CDE共承办新的药品注册申请有5155个(以受理号计,数据统计截止2021年06月30日,下同),与2020年相比,受理总数占2020年的49.9903%;其中化药受理3800个,占2020年的48.05868%;中药大幅上升有401件,为2020年的84.95763%;生物药945件,与2020年差距不大,为50.58887%。2021年申报受理详情和与2020年比较具体情况见图1和图2。
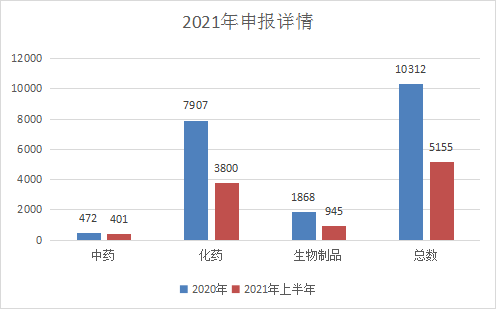
图1 2021年上半年申报详情
数据来源:药智数据,药智咨询整理
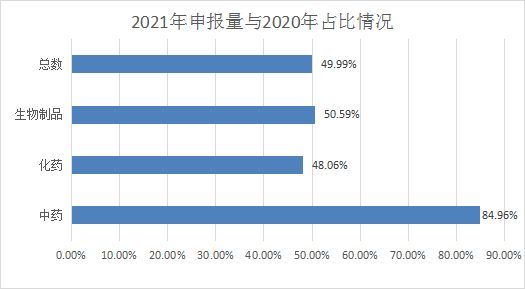
图2 2021年申报受理情况与2020年比较情况
数据来源:药智数据,药智咨询整理
2、每月申报情况
2021年上半年每月受理数量与去年同期相比基本一致,但6月申报与3、4、5月持平,较2020年6月明显减少。2021年上半年每月受理情况详见图3。
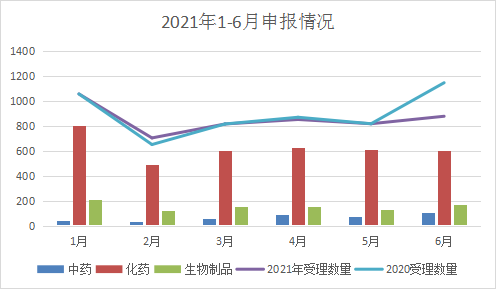
图3 2021年上半年每月受理情况
数据来源:药智数据,药智咨询整理
3、各类申报类型总体情况
2021年各类申报类型为:补充申请:2639 个,占2020受理总量 51.2 %,报临床1162个,报生产932个,申请再注册173个,从下图4和图5可知,和去年的受理号分类相比,2021年上半年补充申请数量降低,申请临床和申报生产数量明显上升。2020年和2021年上半年CDE 药品各申请类型受理情况见图4和图5。
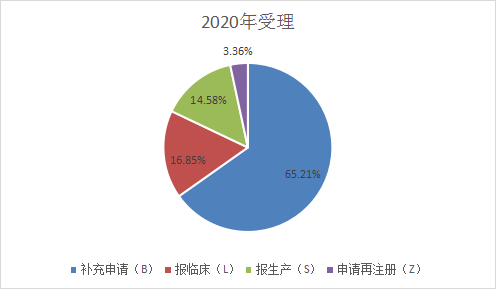
图4 2020年申报受理分类
数据来源:药智数据,药智咨询整理

图 5 2021年1-6月申报受理分类
数据来源:药智数据,药智咨询整理
注:统计规则:S、L、B、Z 分别是受理号第 4 位字母
4、国产创新药受理情况
2021年1-6月CDE受理国产1类创新药注册申请622个,其中受理临床申请601个,上市申请21个。按药品类型统计,化学药403个,生物制品193个,中药26个。
5、进口创新药及原研药受理情况
2021年1-6月CDE受理5.1类化学药进口原研药注册申请73个,受理1类进口创新药注册申请149个。
6、2021上半年化药审评完结情况
根据药智注册与受理数据库最新统计,2021年(注:CDE承办日期从2021年1月1日至2021年06月30日)审评完结受理号数量(指药智网中收录到审评结论的数量,不包括审评结束,但未公示审评结论的受理号)共计1827个,其中化药1194个,中药250个,生物制品383个。2021 年1-6月 CDE 各药品类型和审评结论情况详见图6。
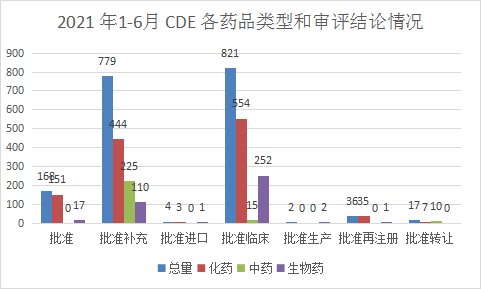
图6 2021 年1-6月 CDE 各药品类型和审评结论情况
数据来源:药智数据,药智咨询整理
7、申报地区情况
在各省市的药品申报方面,江苏以610受理号领先,上海以378屈居第二,随后依次为北京、广东、浙江。 2021年各省市申报情况见图7.
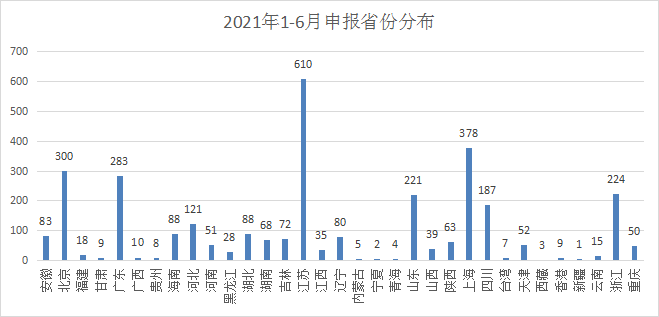
图7 2021年1-6各省份申报分布
数据来源:药智数据,药智咨询整理
以下让我们详细分析一下化药、中药、生物制品、优先审评和突破性治疗的注册受理及审评情况。
二 化药
1、2021上半年化药申报情况
2021 年1-6月CDE共承办新的化药注册申请以受理号计有3801个。2021年每月 CDE 化药受理情况详见图8。
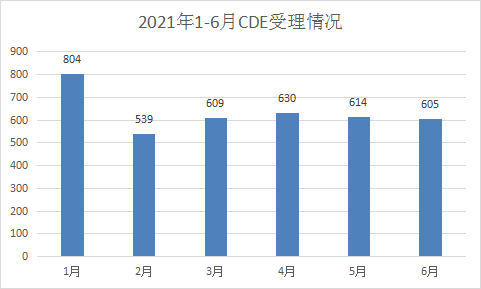
图8 2021年1-6月CDE受理情况
数据来源:药智数据,药智咨询整理
化药注册申请中,IND受理申请706个,NDA受理申请81个,ANDA受理申请782个,受理一致性评价申请432个;2021年1-6月化学药各类注册申请受理情况详见图9。
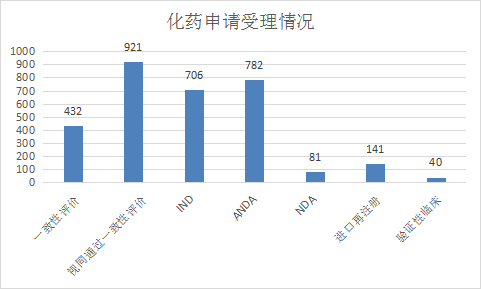
图9 2021年1-6月化学药各类注册申请受理情况
数据来源:药智数据,药智咨询整理
从化药申请类型看,补充申请还是占主要,2021年化药补充申请注册申报受理1879个,占到了化药申报总量的49.43%。2021 年 CDE 化药各申请类型受理情况详见图10。
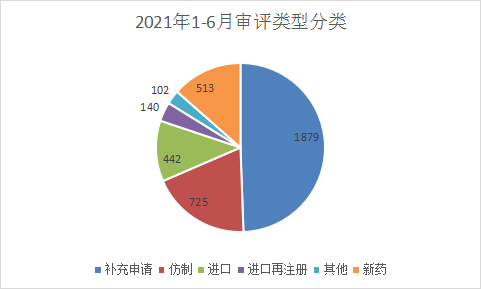
图10 2021年1-6月审评类型分类
数据来源:药智数据,药智咨询整理
1.1 化药1 类新药申报情况
按现行化药注册分类,化药1类定义为:境内外均未上市的创新药,包含含有新的结构明确的、具有药理作用的化合物,且具有临床价值的药品。
2021年1-6月申报1类化学创新药的注册申请共有686个,与去年同期相比增加了88.46%,其中IND申请535个,NDA申请17个,2021年1-6月每月化药1 类新药受理情况和2020年同期对比情况详见图11。
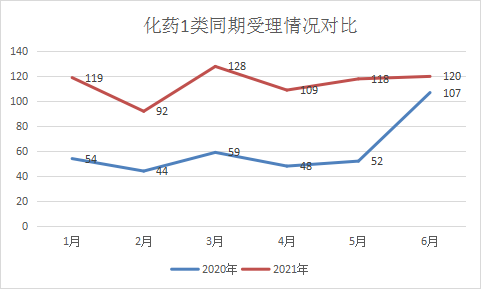
图11 2021年与2020年同期化药1类受理情况对比
数据来源:药智数据,药智咨询整理
1.2 化药1 类新药(国产)、进口申报情况
686个1类化学药创新药注册申请中以国产化学创新药为主,国产化学药创新药注册申请以受理号计有403个,进口化学药创新药注册申请以受理号计有149个,化学药创新药注册申请补充申请以受理号计有134个,其中国产化学药创新药注册补充申请92个,进口化学药创新药注册补充申请42个。2021年化药1类新药、进口注册申请受理情况详见图12。
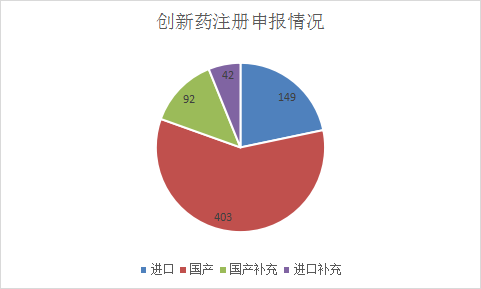
图12 2021年化药1类新药、进口注册申请受理情况
数据来源:药智数据,药智咨询整理
1.3一致性评价受理情况
随着一致性评价的持续进行,2021年与2020年同期CDE受理一致性评价补充受理数量一致,均为432个,两年的一致性受理中,1月均为受理峰值,2021年为110个,但与去年相比,2、3、4、5、6月受理数量差异不大,2021年上半年每月一致性评价受理情况和2020年同期一致性评价对比情况见图13。
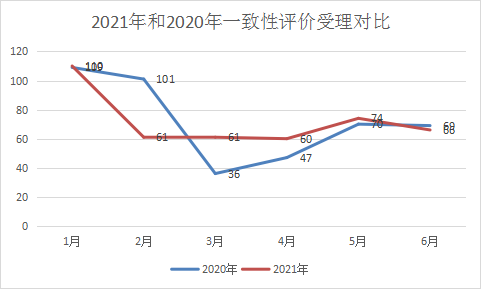
图13 2021年和2020年一致性评价受理对比情况
数据来源:药智数据,药智咨询整理
2 2021上半年化药审评完结情况
2021年(注:CDE承办日期从2021年1月1日至2021年06月30日)CDE完成审评(指药智网中收录到审评结论的数量,不包括审评结束,但未公示审评结论的受理号)的化学药注册申请1194个,其中补充申请557个,新药299个,进口198个。2021年上半年化药各申请类型完成审评情况详见图14。
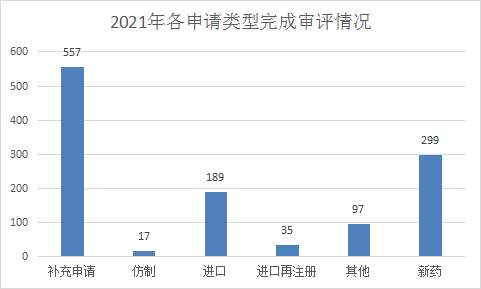
图14 2021年上半年化药各申请类型完成审评情况
数据来源:药智数据,药智咨询整理
2021年审评结论最多由去年的批准补充更换为批准临床,批准补充仍旧占据审评结论的大片江山,具体结论请查询药智网药品注册与受理数据库。2021 年1-6月化药审评结论情况详见图15。
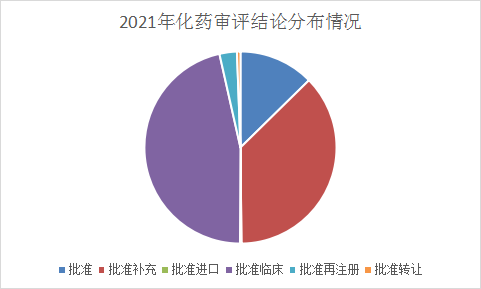
图 15 2021 年化药审评结论情况
数据来源:药智数据,药智咨询整理
注:统计时间为 2021年 07月 0 5日,不同时间点统计会造成审结完成数量和审评结论数量有差异。
二 中药
1、 中药申报情况
2021 年1-6月CDE共承办新的中药注册申请以受理号计有401个。中药受自身药品特性的影响,一直以来申报都处于比较低迷的状态,与去年同期相比,中药受理的数量较去年同期有显著上升;今年新药申请32个,其中25个IND申请和7个NDA申请,其中新药申请主要是在1月和4月较多,分别为10个和9个,其余月份申报数量差异不大;补充申请仍旧占据中药受理的大半江山,今年受理364个,2021 年1-6月 CDE 中药受理情况与2020年同期受理情况对比详见图16,2021年中药受理情况见图17。
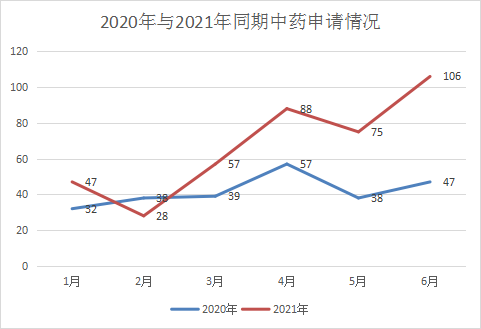
图16 2020年与2021年同期中药申请情况对比
数据来源:药智数据,药智咨询整理
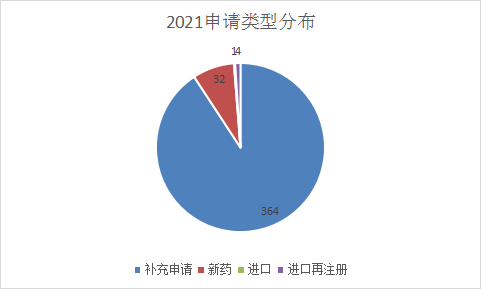
图17 2021年中药受理分布情况
数据来源:药智数据,药智咨询整理
2、中药注册申请审评完成情况
2021年(注:CDE承办日期从2021年1月1日至2021年06月30日)CDE完成审评(指药智网中收录到审评结论的数量,不包括审评结束,但未公示审评结论的受理号)的中药注册申请250个,其中批准补充225个,批准临床15个(新药IND申请13个,申请补充2个),批准转让10个。2021年上半年中药个申请类型审评完成情况见图18。
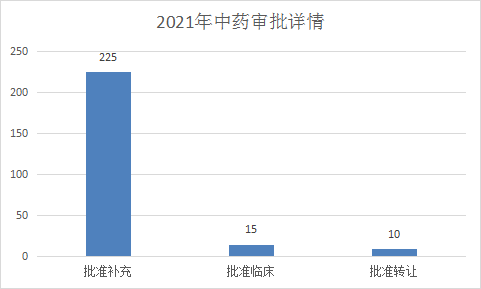
图 18 2021年1-6月中药各申请类型的审评完成情况
数据来源:药智数据,药智咨询整理
注:统计时间为 2021年 07月 0 5日,不同时间点统计会造成审结完成数量和审评结论数量有差异。
三 生物制品
1、生物制品申报情况
2021 1-6月CDE共承办新的生物制品注册申请以受理号计有945个,约占去年受理总数的50%。和去年上半年受理数量逐渐上升相比,2021年除1月受理较多,其余月份受理数量总体趋势较平稳。2021年每月 CDE 生物制品受理情况和2020年同期受理情况详见图19。
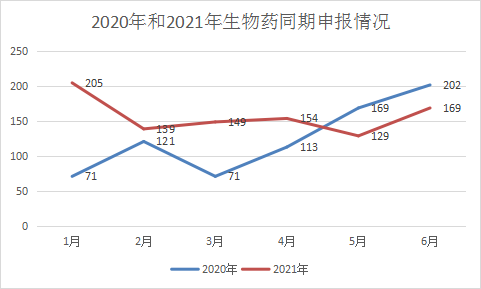
图 19 2021 年每月 CDE 生物制品受理情况
数据来源:药智数据,药智咨询整理
2021年CDE受理生物制品注册申请945件(主要为治疗用生物制品申请受理),其中受理生物制品临床试验申请381件(预防用生物制品12件,治疗用生物制品369件),受理生物制品补充申请438件(预防用生物制品69件,治疗用生物制品344件),受理生物制品上市申请65件(预防用生物制品7件,治疗用生物制品58件)。2021年1-6月生物制品各类注册申请受理情况详见图20。
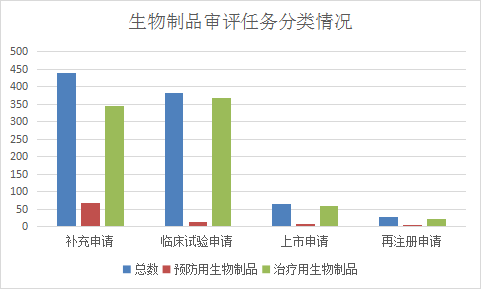
图 20 2021年1-6月生物制品各类注册申请受理情况
数据来源:药智数据,药智咨询整理
2、1类生物制品创新药受理情况
CDE受理1类生物制品创新药注册申请310个,较去年全年336个有明显大幅上升,其中预防用生物制品7个,治疗用生物制品303个。1类生物制品创新药注册申请中,临床试验申请262个(预防用生物制品6个),上市申请1个(治疗用生物制品)。
3、 生物制品注册申请审评完成情况
2021年(注:CDE承办日期从2021年1月1日至2021年06月30日)CDE完成审评(指药智网中收录到审评结论的数量,不包括审评结束,但未公示审评结论的受理号)的生物制品注册申请共382个,其中完成临床申请的192个(预防用生物制品7个,治疗用生物制品185个),补充申请的163个(预防用生物制品17个,治疗用生物制品146个)。2021年1-6月生物制品各申请类型的审评完成情况详见图22

图 21 2021年1-6月生物制品各申请类型的审评完成情况
数据来源:药智数据,药智咨询整理
注:统计时间为 2021年 07月 0 5日,不同时间点统计会造成审结完成数量和审评结论数量有差异。
四 优先审评品种纳入情况
2021年CDE将50个受理号注册申请纳入优先审评程序,其中化药25个,生物制品23个,中药2个,其中儿童用药13个、其他优先审评审批情形13个、符合附条件批准的药品12个;适应症包括特发性矮小症、银屑病、癌症等多个领域。
五 突破性治疗品种纳入情况
申请适用突破性治疗药物程序条件:药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病,且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等。
2021年1-6月CDE将26个(按受理号计)注册申请纳入突破性治疗品种,仅有勃林格殷格翰(中国)投资有限公司JXHL2100015一个受理号是CDE在2021-01-01之后受理,适应症为精神分裂症;详细内容请查看药智网药品注册与受理数据库。
数据来源:药智药品注册与受理数据库