看点:
1、26个新药获得临床试验默示许可,包括12个国产1类新药
2、CDE新受理41个新药(52个受理号)的临床试验申请
3、贝达药业PD-1 抗体和CTLA-4 抗体联合疗法获批临床
4、恒瑞又有两款1类新药获批临床!
药智数据显示,本期(7月9日至7月16日)有26个新药获批临床(32个受理号);另有41个品种(52个受理号)临床申请获CDE承办受理,更多动态如下:
新药临床申请·新获批
本期,26个新药(32个受理号)获得临床试验默示许可,包括12个国产1类新药。获批临床的创新药包括PD-1 抗体、CTLA-4 抗体、CD20单抗、HER3 ADC、FAK抑制剂、BCL-2抑制剂,适应症涵盖儿童近视、麻醉、实体瘤、特应性皮炎、卒中、单纯疱疹病毒等。

数据来源:药智数据
1.SBK001注射液
该药是成都施贝康生物自主研发,并获批临床的第二个化学1类新药。SBK001注射液为全新作用机制、全新化合物,拥有全球专利;适应症为:用于急性肺损伤(acute lung injury,ALI),例如手术、病毒或细菌等引起的急性肺损伤的预防性治疗。
2.IN10018片
该药是勃林格殷格翰开发的一款FAK抑制剂,应世生物现在拥有该药的全球开发和商业化权利。研究发现,联合FAK抑制剂(IN10018)和KRAS G12C抑制剂的治疗策略能实现协同抗癌作用,可以同时降低其耐药反应使抗癌作用更加持久。IN10018在中国获得多项临床试验默示许可,适应症为局部晚期或转移性胃或胃食管交界处腺癌,与PD1联合治疗晚期或转移性非小细胞肺癌,与化疗联合治疗高级别浆液性卵巢癌(包含输卵管癌和原发性腹膜癌),局部晚期或转移性实体瘤等多项临床试验,以及本次获批的HRAS突变的实体瘤。
3.注射用硝酮嗪
该药是喜鹊医药从暨南大学独家转让的1类化学创新药物,具有独特的作用机理。硝酮嗪高效清除自由基,保护线粒体功能,增加ATP产生,促进细胞自噬,恢复细胞活力。注射用硝酮嗪获批临床适应症为用于治疗急性缺血性脑卒中(联合血管内治疗)。此外硝酮嗪片治疗ALS目前正在中国开展II期临床研究。
4.SHR-1906注射液
该药是恒瑞医药研发的1类新药,适应症为特发性肺纤维化IPF。据公开信息推测,SHR-1906为CTGF抗体,这也是首款国产CTGF抗体。CTGF是一种多功能肝素结合糖蛋白,通常低水平表达,但在几乎所有纤维化病症中显着富集。
5.泽贝妥单抗注射液
该药是海正药业子公司浙江博锐生物开发的一款CD20单抗。泽贝妥单抗为差异化的CD20抗体,为IgG1亚型的嵌合抗体,从泽贝妥单抗的氨基酸序列来看,严格来说此产品属于利妥昔单抗的生物类似药。
6.UB-621注射液
该药联药生物旗下一款针对单纯疱疹病毒(HSV)所开发的全人化IgG 1单株抗体药物。UB-621可诱讨寸和病毒(HSV-1和HSV-2)外表包膜上gD蛋白之靶点作高亲和力结合的机制,阻止病毒侵入宿主而抑制感染。2020年8月,该产品首次在中国申报临床,适应症:治疗成人复发性生殖器疱疹。
7.CAN106注射液
该药是一种作用于补体系统C5靶点的长效人单克隆抗体,用于治疗阵发性睡眠性血红蛋白尿症(PNH)。此前,该品种于2020年12月获得新加坡卫生科学局(HSA)的IND批准,目前正在进行I期安全性试验。北海康成正在研发的CAN106可用于治疗与补体失调相关的多种遗传性疾病。
8.ZN-d5片
该药是Zentalis Pharmaceuticals公司开发的B细胞淋巴瘤2(BCL-2)的口服选择性抑制剂,获批适应症为非霍奇金淋巴瘤。BCL-2是一种蛋白质,在调节细胞死亡中起关键作用。在许多癌症类型中检测到BCL-2的过表达,BCL-2抑制剂通过恢复肿瘤细胞的凋亡,已成为癌症治疗的重要靶标。
9.RRx-001注射液
该药是一种具有良好安全性的下一代小分子免疫疗法,靶向CD47–SIRPα轴。作为一种具有将“对治疗耐受”的肿瘤转化为“对治疗敏感”的肿瘤的潜在免疫疗法,RRx-001可以用作单一疗法或与化疗、其他免疫疗法、放疗和靶向药物联合使用。赛生医药授权引进自美国EpicentRx,并获得中国内地、香港、澳门、台湾10年专利商业化许可。本次获批适应症为广泛期小细胞肺癌。
10.硫酸阿托品滴眼液
该药是欧康维视开发的一款低浓度阿托品0.01%滴眼液,近日OT-101获国家药监局批准开展Ⅲ期临床试验,用于治疗儿童近视。低浓度阿托品溶液不稳定,长久以来存在商业化的技术障碍,而欧康维视开发的贮存及给药系统能够解决该问题。此前,OT-101的Ⅲ期临床研究已获得美国FDA批准,2021年5月,OT-101国际多中心Ⅲ期临床试验在英国获受理。
11.U3-1402
该药第一三共开发的 HER3靶向抗体偶联药物(ADC)新药,拟用于非小细胞肺癌(NSCLC)。该药抗体部分 Patritumab 是 U3 pharma 与安进共同开发的靶向 HER3 的单抗,2008 年第一三共收购了 U3 pharma,获得其在研的 patritumab 及其相关的知识产权;2016 年,由于临床数据不佳,第一三共终止了 Patritumab 用于治疗 NSCLC 的研发,不过 ADC 技术的出现使这个单抗焕发了新的生机,第一三共将其开发为 ADC 药物,获得了 U3-1402。U3-1402在国外进展至Ⅱ期临床。
12.巴替利单抗注射液/泽弗利单抗注射液
巴替利单抗和泽弗利单抗是贝达药业从Agenus引进项目,贝达药业拥有中国区域内(包括香港、澳门和台湾)单用或联合其他药物治疗除膀胱内给药外的所有适应症上的独家开发并商业化巴替利单抗和泽弗利单抗的权利。本次巴替利单抗注射液 和泽弗利单抗注射液联用治疗晚期实体瘤的两项药品临床试验已获得国家药品监督管理局批准开展,拟用于晚期实体瘤的治疗。
巴替利单抗是Agenus开发的肿瘤免疫单克隆抗体,是一种与程序性死亡受体1(PD-1)相结合的重组单克隆抗体,具有抑制PD-1与其配体(PD-L1、PD-L2)结合的能力。泽弗利单抗是一种人抗细胞毒T淋巴细胞抗原-4(CTLA -4)单克隆抗体(Mab),可抑制CTLA -4对肿瘤特异性T细胞免疫应答的抑制作用。
新药临床申请·新受理
本期,CDE新受理41新药(52个受理号)临床申请。其中,35个品种(43个受理号)为国产新药,6个品种(9个受理号)为进口新药,更多动态如下:
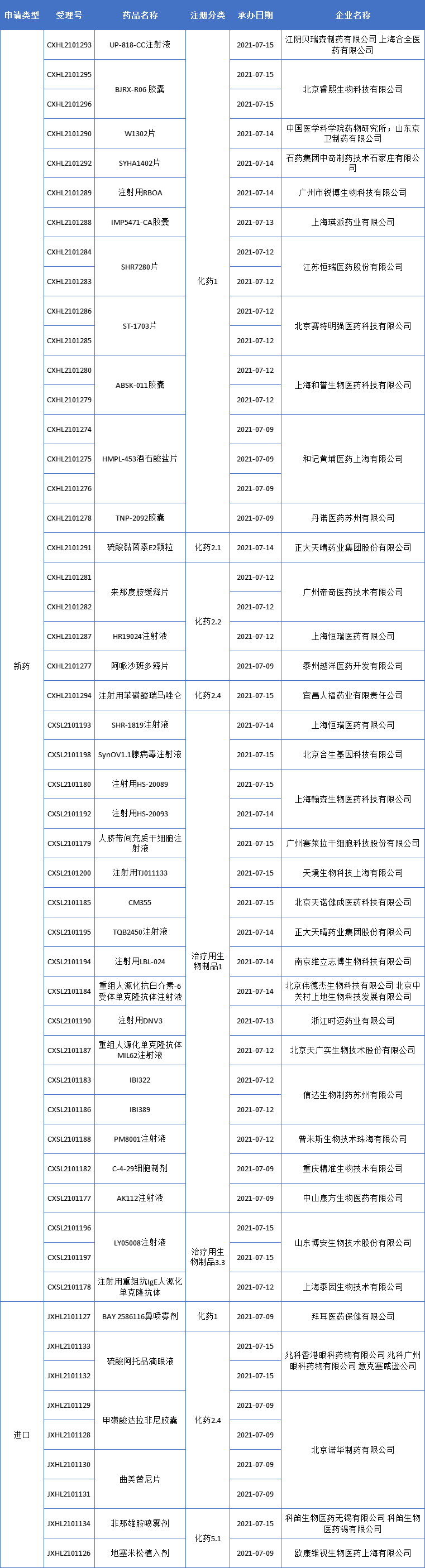
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息