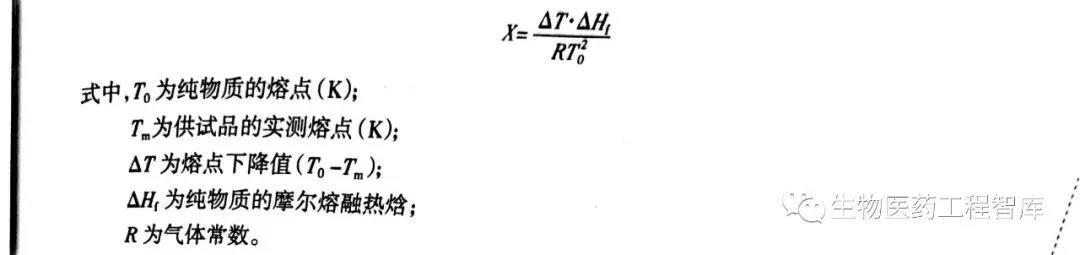来源:生物医药智库
检查药物中存在的微量杂质,首要的问题就是要选择一个专属性强的方法,使药物对业含微量杂质的检测也不产生干扰。所以药物中杂质的检查主要是依据药物与杂质在物理楼或化学性质上的差异来进行。
药物与杂质在物理性质上的差异,主要指药物与杂质在外观始分配或吸附以及对光的吸收等性质的差别;在化学性质上的差异,主要指药物与杂质对某学反应的差别,一般地,是杂质与试剂反应,而药物不反应。根据杂质的控制要求,可以进行量检查,也可以对杂质进行定量测定。
杂质的研究规范
制药企业应该按照经国家药品监督管理部门依法审查批准的规定工艺和规定原辅料进行药品的生产,如果变更生产工艺或原辅料,并由此而带进新的杂质,需对原质量标准进行修订,并应依法向有关药品监督管理部门申报批准。在新药的研发中,应该对新药中的杂质进行检测和安全性研究。
杂质控制要合理,即合理地确定杂质检查项目与限度,合理地选择杂质检查方法。有机杂质在药品质量标准中的项目名称:
1、以杂质的化学名称作为项目名称
当被检查的杂质是已知化合物时(特定杂质),就以该化合物的化学名称作为质量标准中的项目名称。例如:卡比马唑及其片剂中的“甲巯咪唑',阿司匹林中的“游离水杨酸”、磷酸可待因中的“***”等。如果杂质的化学名太长,又无通用的简称,可选用相宜的简称或习称作为项目名称,并在质量标准起草说明中应写明该已知杂质的结构式。例如:肾上腺素中的“酮体”。
2、以某类杂质的总称作为项目名称
当杂质不能明确为单一物质而又知为某一类物质时,则以这类物质的总称作为项目名称。例如:硝酸毛果芸香碱中的“其他生物碱”、山梨醇中的“还原糖”和“总糖”、***中的“有关物质”、许多原料药物中的'残留溶剂'等。
3、以检测方法作为项目名称
当被检查杂质的结构未知,亦不属于具体的类别时,根据检查方法相应的名称作为项目名称。例如:“杂质吸光度”,“溶液透光率”、“易炭化物',“不挥发性杂质”等。
杂质检查项目的确定
杂质检查项目的确定要有针对性。药品标准中的杂质检查项目,应包括药物在质量研究和稳定性考察中检出的,并在批量生产中出现的杂质和降解产物。所以,原料药和制剂中的杂质检查项目,均应根据其起始原料、生产工艺及稳定性情况确定。
尤其是降解产物和毒性杂质,通常均作为必须的检查项目。除降解产物和毒性杂质外,在原料中已控制的杂质,在制剂中一般不再控制。单一对映体药物,其可能共存的其他对映体应作为杂质检查。消旋体药物,当已有其单一对映体药物的法定质量标准时,应在该消旋体药物的质量标准中设旋光度检查项目。
杂质限度的确定
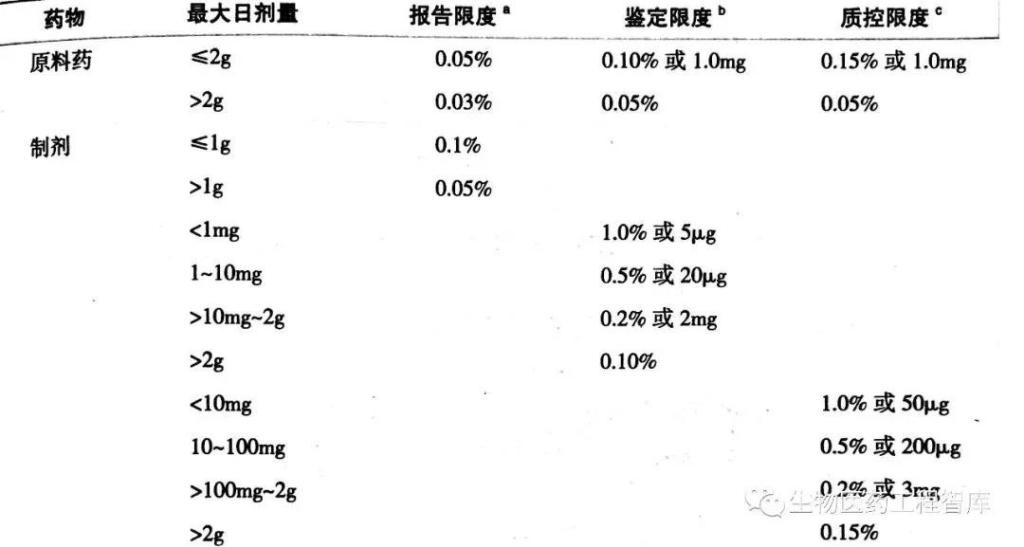
杂质限量的确定要合理,在确保用药安全有效的前提下,应考虑到生产的可行性及批与批之间的正常波动,还要考虑药品本身的稳定性。可以根据原料药每日剂量来制订质控限度。
如果所制订的限度超过该限度值,就必须提供所订限度的合理性依据。有机杂质的限度规定应包括:每一个已知杂质、未知杂质及总杂质。在确定仿制药品的杂质限度时,应与已上市产品进行质量对比研究。
杂质限度的制订应考虑如下因素:
1、杂质及含一定限量杂质的药品的毒理学研究结果:
2、给药途径;
3、每日剂量;
4、治疗周期;
5、给药人群;
6、杂质药理学可能的研究结果;
7、原料药的来源;
8、在保证安全有效的前提下,药品生产企业对生产高质量药品所需成本和消费者对药品价格的承受力等。
对于创新药物,杂质限度确定的依据 主要是已进行的临床前安全性研究中获得的结果,通常是要求用于临床试验的样品杂质不得超过用于临床前安全性研究的样品;对于仿制药物,可以根据已有的标准制订相应的杂质限度; 对于其他新药,可参照创新药物或仿制药物的要求进行。
杂质检查方法的选择与验证
药物中杂质的检测方法包括化学法、光谱法、色谱法等,因药物结构及杂质的不同采用不同的检测方法。有机杂质的检测方法多采用色谱法,特别是HPLC法。
用于杂质检查的分析方法要求专属、灵敏。为验证杂质分析方法的专属性,可根据原料药或制剂的生产工艺及储存条件,以中间体、立体异构体、粗品、重结晶母液、经加速破坏性试验后的样品作为测试品进行系统适用性研究,考察产品中各杂质峰及主成分峰相互间的分离度是否符合要求。
当采用HPLC法检查有机杂质时,由于等度洗脱具有可能漏检杂质的缺点,所以国内外药典中也常常采用梯度洗脱,例如司帕沙星、丝裂霉素、地高辛、辛伐他丁等药物中有关物质检查都采用了梯度洗脱。
分析方法的检测限一定要符合质量标准中对杂质限度的要求,检测限不得大于该杂质的报告限度。
杂质的常用检查方法
杂质检查常用的方法包括:化学方法、色谱方法、光谱方法和物理方法等。
一、化学方法
当药物中杂质与药物的化学性质相差较大时,可选择合适的试剂,使之与杂质发生化学反应,产生颜色、沉淀或气体,从而检查杂质的限量。采用化学检査法除了对杂质进行半定量检查外,还可采用滴定法和重量法对杂质进行定量测定。
1、显色反应检查法
当杂质与试剂产生颜色时,采用比色法控制杂质的限量,多为目视比色。
2、沉淀反应检查法
当杂质与试剂产生沉淀时,采用比浊法控制杂质的限量故可以采用重量法测定杂质的量。
3、生成气体的检査法
当杂质与试剂反应产生气体时,采用相应的气体检查法来控制杂质的限量。
4、滴定法
滴定剂只与杂质反应,以一定浓度的滴定液滴定药物中的杂质,可以定量地测定杂质的含量。
二、色谱方法
药物中的有机杂质,可能是已知的或未知的、挥发性的或不挥发性的,其结构和性质往往和药物相近。如果药物和杂质与某些试剂的反应相同或相似,或者它们的光谱特征相似,这时就难以采用化学法和光谱法对杂质进行检查。
由于色谱法可以利用药物与杂质的色谱性质的差异,能有效地将杂质与药物进行分离和检测,因而色谱法广泛应用于药物中杂质的检查。
药物中的有关物质包括起始原料、中间体、副产物、异构体、聚合体和降解产物等,它们的化学结构常常与药物类似或具有渊源关系。色谱法是有关物质检查的首选方法。
1、薄层色谱法
TLC被许多国家药典用于药物中杂质的检查,具有设备简单、操作简便、分离速度快、灵敏度和分辨率较高等优点。
常用的方法有:杂质对照品法、供试品溶液的自身稀释对照法、或两法并用法、以及对照药物法。质量标准中应规定杂质的个数和限度。
杂质对照品法:适用于已知杂质并能制备杂质对照品的情况。
方法:根据杂质限量,取供试品溶液和一定浓度的杂质对照品溶液,分别点样于同一薄层板上,展开、斑点定位。供试品溶液除主斑点外的其他斑点与相应的杂质对照品溶液或系列浓度杂质对照品溶液的相应主斑点进行比较。判断药物中杂质限量是否合格。
2、高效液相色谱法
高效液相色谱法分离效能高、专属性强和检测灵敏性好,可以准确地测定各组分的峰面积,在杂质检查中的应用日益增多。对于使用高效液相色谱法测定含量的药物,可采用同一色谱条件进行杂质检查。
检测杂质有四种方法:外标法(杂质对照品法)加校正因子的主成分自身对照测定法、不加校正因子的主成分自身对照法、面积归一化法。
3、气相色谱法
气相色谱法用来测定药物中挥发性特殊杂质,特别是药物中的残留溶剂的记检查,各国药典均规定采用气相色谱法。
方法:除了有与高效液相色谱法相同的杂质检查方法外,还有“标准溶液加入法”,将一定量的杂质对照品溶液精密加人到供试品溶液中,根据外标法或内标法测定杂质的含量,再扣除加积入的对照品溶液含量,即得供试品溶液中杂质的含量。
4、毛细管电泳法
毛细管电泳法可以用于多肽、酶类等药物中杂质的检查。检查方法与高效液相色谱法相同。
三、光谱方法
光谱法依据药物和其杂质对光的选择性吸收差异进行杂质的限度检查。
1、紫外-可见分光光度法
利用药物与杂质的紫外-可见吸收特征的差异进行检查。如果药物在杂质的最大吸收波长处没有吸收,则可在此波长处测定样品溶液的吸光度,通过控制样品溶液的吸光度或透光率来控制杂质的含量。也可利用杂质与试剂发生呈色反应,在可见光区,测定杂质的含量。
2、红外分光光度法
某些多晶型药物,由于晶型状态的不同,一些化学分子间非共价键作用的键长、键角等发生不同程度的变化,从而导致红外吸收光谱中某些特征峰的频率、峰形和强度出现特征的差异。利用红外分光光度法对这些差异进行定量测定,可以检查药物中特定的晶型杂质(低效、无效,或影响质量与稳定性)。方法简便,结果可靠。
3、原子吸收分光光度法
原子吸收分光光度法是一种灵敏度很高的测定方法,广泛用于微量金属元素的分析。在杂质检查中,主要是用于药物中重金属杂质的检查。
通常采用标准加人法控制重金属杂质的限量:取供试品,按各品种项下的规定,制备供试品溶液:另取等量的供试品,加人限度量的待测元素溶液,制成对照溶液。设对照溶液的读数为a,供试品溶液的读数为b,b值应小于(a-b)。例如维生素C中铁盐和铜盐的检查。
四、其他方法
1、热分析法
物质在加热或冷却过程中,会发生熔化、凝固、晶型转变、分解化合、吸附、脱附等物理化学变化。这些变化必将伴随体系焓(热量的吸收或释放)的改变,因而产生热效应。
同时根据相律,物相转化时的温度(如熔点、沸点等)保持不变。纯物质具有特定的物相转化温度和相应的热焓变化。这些常数可用于药物的定性分析,而供试品的实际测定值与这些常数的偏离及其程度又可用于供试品的检查纯度。
热分析(thermal analysis) 是在程序控制温度条件下,精确记录物质的物理化学性质随温度变化的关系,研究物质在受热过程中所发生的晶型转化、熔融、蒸发、脱水等物理变化,或热分解、氧化、还原等化学变化,以及伴随发生的温度、能量或重量改变的方法。
热分析法广泛应用于药物的多晶型、物相转化、结晶水,结晶溶剂、纯度、热稳定性,以及基于相容性的固体分散系统、脂质体、药物辅料相互作用(预测药物与赋形剂间的可配伍性)等的研究。常用的热分析法有热重分析(TG)和差示扫描量热分析(DSC)。
热重分析:热重分析法(thermogravimetric analysis,TG)是利用热天平在程序控制温度的条件下,测量物质的重量随温度变化的曲线(热重曲线,TG曲线),以便研究物质的重量变化及其内在性质与温度的相关特征。即,用于分析供试品的受热内在稳定性行为。
当被测物质在加热过程中有升华、汽化、分解出气体或失去结晶溶剂时,被测物质的重量就会发生变化。这时热重曲线就不是直线,而是记录到重量的下降。
通过热重曲线的分析,可以测得被测物质产生重量变化时的温度与范围。并且根据减失重量曲线行为,可以估算出被分析物在加热过程中,失去的组分特征和失去的量值。
2、热分析法应用
(1)熔点和分解点测定
固体有机药物通常具有特征熔点。很多物质在加热过程中同时失重,或由于化学反应产生挥发性物质。将DSC法与TG法结合使用,既可以由测得的熔点验证药物的真伪,又能够根据与熔融相应的热重行为分析药物的熔融稳定性行为以及药物的受热分降解特征。
(2)多晶型及其转变的表征
多晶型(polymorphs)是大多数有机药物的常见现象。 在温度影响下,晶型转变且伴有热效应,故可用DSC或DTA研究晶型转变或判定晶型。
(3)药物的纯度测定
化学固体纯物质(如固体有机药物)大多均具有一定的熔点(T)或无限窄的熔距,熔融相变时吸收一定的热量。当化学固体物质中含有杂质时,将导致物质化学纯度的下降,同时引起化学固体物质的熔距展宽或熔点下降。
若药物中的杂质量达一定比例,供试品的熔点可达一最小值,此值称为最低共熔点,相应的杂质称为低共熔杂质。药物或铺料与杂质的低共熔行为是采用 DSC 法测定其纯度的基础。杂质的存在使得药物熔点下降,熔距变宽,根据范特霍夫(Van'tHoff)方程,则可计算出杂质的含量(X表示所含杂质的摩尔分数):
含有低共熔杂质的供试品(又称低共熔混合物)被加热至最低共熔点时,所含药物和杂质按低共熔混合物组成的比例熔化,体系温度不变;继续加热,至杂质完全熔出后,温度升高,药物熔化量增大,液相中杂质的浓度逐渐降低,熔点逐渐升高。
对杂质作限量检查时,只需将供试品的DSC(DTA)曲线与标准样品(含有限量杂质的供试品)的曲线比较即可。
热分析法检查药物纯度注意事项:
① 供试品纯度在98.0%以上;
② 杂质不与主成分反应;
③ 杂质不与主成分形成共晶或固熔体;
④ 杂质与熔融试样有化学相似性;
⑤ 药物在熔融过程中化学性稳定;
⑥ 药物如存在多晶现象则必须全部转变成某一晶型。
利用范特霍夫方程测定纯度时,是建立在杂质不形成固溶体的假设之上的,所以本法的应用具有一定的局限性,特别是当供试品为混晶物质(即不同晶型的混合物熔点值无差异)或熔融时分解的物质,则难以准确地测定其化学或晶型纯度。
无定型态固体物质(或非晶态物质)可能没有明确的熔点或呈现宽熔距现象,其熔距宽度与物质的化学纯度或晶型纯度无关。所以,无定型固体物质状态亦不符合范特霍夫方程规律。
3、热分析的联用技术
热分析过程中,针对供试品的分降解产物进行进一步的检测研究,既可以进一步探索供试品的分降解机制,还可以研究供试品的热稳定性特征。所以,热分析联用技术(TG-IR和TG-MS等)在药品及材料研究中也发挥着重要作用。
这些联用手段,尤其是灵敏、快速的TG-MS,可以监测供试品在受热过程中所发生的各种物理、化学变化,对分解或降解产物的化学成分进行定性或定量分析,从而可更好地建立分解模型,阐述分解机制,已成为研究各种无机、有机和高分子材料的热稳定性和热分解(降解)过程的重要实验方法。