近日,CDE最新公示消息,又一批药品拟纳入优先审评。包括百济神州的替雷利珠单抗、信达首款小分子抗癌新药pemigatinib片、协和麒麟的First-in-classCCR4抑制剂莫格利珠单抗等在内。
近一周CDE拟纳入优先审评名单
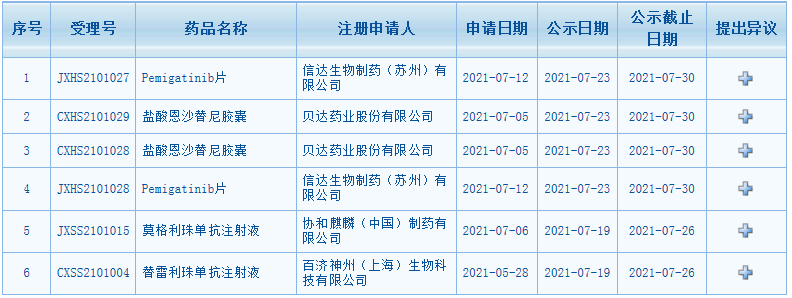
图片来源:CDE
基石药业艾伏尼布
艾伏尼布(Ivosidenib)是一款first-in-class、具有选择性的、针对IDH1基因突变癌症的强效口服靶向抑制剂。2018年7月获得FDA批准上市,成为全球首个且唯一一个获得FDA批准治疗携带易感IDH1突变的成人复发或难治性急性髓系白血病(R/RAML)药物。FDA还分别在2018年和2019年向此药授予了用于急性髓细胞性白血病和胆管癌的孤儿药称号及突破性疗法。
艾伏尼布最初由AgiosPharmaceuticals开发,2018年6月,基石药业与后者宣布达成独家合作与授权许可协议,推进艾伏尼布(Ivosidenib)在大中华地区(中国大陆、香港、澳门及台湾地区)以及新加坡地区的独家临床开发与商业化权利。
2019年7月,中国国家药品监督管理局批准了基石药业针对艾伏尼布(Ivosidenib)的一项桥接注册性I期试验,以治疗携带IDH1基因突变的复发或难治性急性髓系白血病患者。
2020年10月,艾伏尼布被纳入中国国家药品监督管理局药品审评中心发布的“临床急需境外新药名单(第三批)”
7月26日,中国国家药品监督管理局(NMPA)药品审评中心(CDE)网站信息显示,基石药业艾伏尼布(ivosidenib)上市申请拟纳入优先审评;适应症是“用于治疗携带易感IDH1突变的成人复发性或难治性急性髓系白血病”。充分显示了艾伏尼布优越的临床优势。
信达首款小分子抗癌新药pemigatinib片
Pemigatinib属于纤维细胞生长因子受体(FGFR)亚型1/2/3的强效选择性口服抑制剂。公开资料显示,Pemigatinib最初由Incyte开发,2018年12月,信达生物与Incyte就pemigatinib等三个Incyte发现并研发的处于临床试验阶段候选药物达成战略合作。根据协议条款,信达生物拥有pemigatinib在中国大陆、香港、澳门和台湾地区的开发和商业化权利。
其中,2021年6月21日pemigatinib(商品名:达伯坦)已在台湾市场获批,是信达生物获批的第一款小分子药产品,也是信达生物第五款获批上市的创新药。用于治疗成人接受过全身性药物治疗、肿瘤具有成纤维细胞生长因子受体2(FGFR2)融合或重排、不可手术切除的局部晚期或转移性胆管癌。此外,今年3月在中国开展的一项针对晚期胆管癌患者的关键性试验已完成首例患者给药。
据药智数据药品注册时光轴显示,pemigatinib申报上市被NMPA受理到纳入优先审评仅仅只用了11天时间,适应症为既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者的治疗。

图片来源:药智数据
另值得提及的是,2020年4月FDA批准Incyte公司Pemazyre®用于治疗既往接受过治疗的成人晚期/转移性或不可切除的FGFR2基因融合/重排型胆管癌(通过FDA批准的检测方法确认),另据信达企业官微消息显示,该适应症的继续批准可能取决于确认性试验中对临床益处的验证和描述。成为首款胆管癌靶向药,实现了胆管癌靶向治疗从无到有新突破!
且据药智数据全球畅销药品销售数据库显示,2020年Pemazyre®销售额已达1.6亿元;现在国内短时间该品种拟纳入优先审评序列,不出意外,有望加速获批,给中国胆管癌患者带来临床获益的同时,进一步提高该品种亮眼的销售数据。
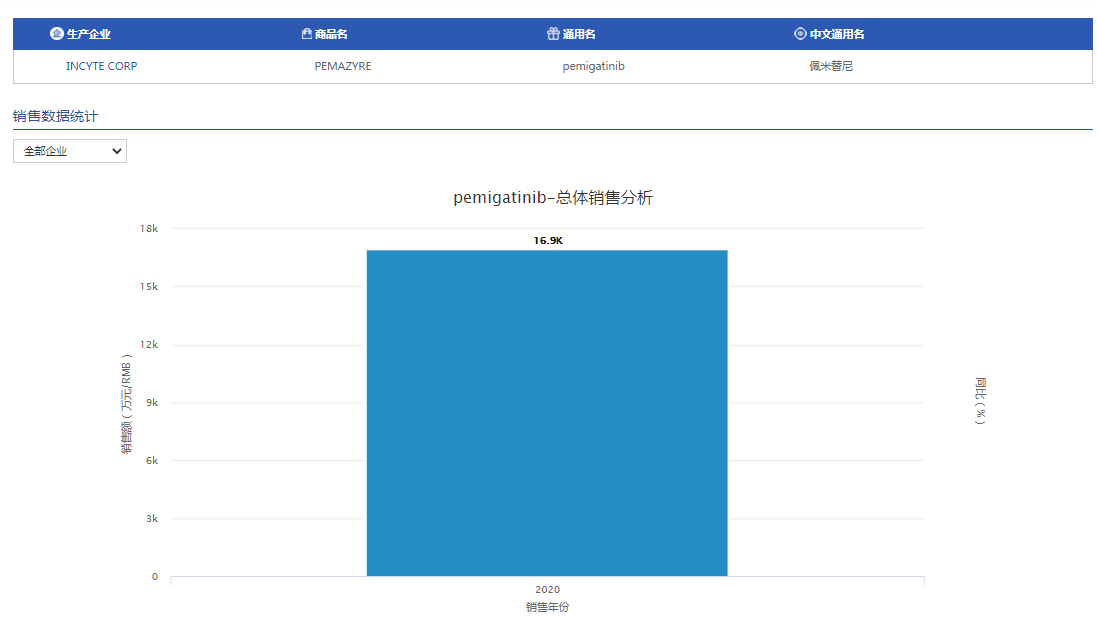
图片来源:药智数据
贝达药业盐酸恩沙替尼一线治疗适应症拟纳入优先审评
盐酸恩沙替尼是一种新型强效、高选择性的新一代ALK抑制剂,是贝达药业和控股子公司Xcovery共同开发的全新的、拥有完全自主知识产权的创新药;是贝达药业在肺癌领域继EGFR-TKI后的又一重大布局产品,有望成为首个由中国企业主导在全球上市的肺癌靶向创新药。
盐酸恩沙替尼作用机理图
图片来源:贝达药业官微
众所周知,无论是在全球范围,还是在中国,肺癌的发病率和死亡率都高居榜首,被称为“众癌之首”。肺癌分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),其中非小细胞肺癌占了80%-85%。故而,行业间就有说“得肺癌靶向药者得天下”。
2020年11月盐酸恩沙替尼正式获批上市,成为中国第一个用于治疗ALK突变晚期非小细胞肺癌的国产1类新药,同时是贝达药业继凯美纳(盐酸埃克替尼)之后,第2款获批上市的创新药。
2021年7月13日,盐酸恩沙替尼胶囊(贝美纳®)拟用于“适用于间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的治疗”的上市许可申请获得NAPA受理,现仅一周时间拟纳入优先审评名单,有望快速获批,带来新的业绩增长点。
此外,值得提及的是,据贝达药业官微显示,本次盐酸恩沙替尼是采用eXalt3研究结果申报一线治疗适应症。eXalt3研究是一项全球开放多中心随机对照Ⅲ期临床研究,涉及21个国家和地区的123个研究中心,全球总计入组290名患者,中国入组140名患者。
研究结果显示,截至2020年12月8日,在意向治疗(ITT)人群中,恩沙替尼组患者的中位PFS(基于独立评审委员会IRC)显著长于克唑替尼组(31.3个月vs12.7个月),而在mITT人群中,恩沙替尼INV评估的中位PFS达到33.2个月,随访中位数为27.6个月。
协和麒麟的First-in-classCCR4抑制剂莫格利珠单抗
莫格利珠单抗注射液(Mogamulizumab)是抗CC趋化因子受体4(CCR4)单克隆抗体,是由协和发酵株式会社研发,并已相继在日本和美国上市:
2012年首次在日本获批用于治疗成人T细胞白血病/淋巴瘤(ATLL);
2014年在日本获批用于外周T细胞淋巴瘤(PTCL)和皮肤T细胞淋巴瘤(CTCL);
2018年8月8日获FDA批准用于至少接受过一次全身治疗后复发或难治性蕈样真菌病(MF)或Sézary综合征(SS)的成年患者。是首个在美国获批上市的靶向CCR4的生物制品,曾获FDA突破性疗法认定和优先审评资格。
近日,这款First-in-classCCR4抑制剂在中国申报上市被受理,并快速纳入拟纳入优先审评名单,适用于既往接受过至少一次全身性治疗的蕈样肉芽肿(MF)或Sézary综合征(SS)成人患者的治疗。数据显示,蕈样真菌病占所有皮肤淋巴瘤的50%-70%,它能够导致瘙痒的红疹和皮肤伤口,且可扩散到身体其它部位;塞扎里综合症则是影响血液和淋巴结的一种罕见皮肤淋巴瘤;MF的白血病阶段,与红皮病相关联,约占皮肤T细胞淋巴瘤的3%。
根据,日本药企协和麒麟(KyowaKirin)近日公布评估蕈样肉芽肿或塞扎里综合征成人患者对抗体药物Poteligeo(mogamulizumab,莫格利珠单抗)的治疗反应的3期MAVORIC试验的新数据显示,在研究者评估的无进展生存期(PFS)方面,与Zolinza治疗组相比,Poteligeo治疗组显著延长(7.7个月vs3.1个月;p<0.0001)。Poteligeo比Zolinza更有效,特别是对于那些被认为预后更差的血液受累患者。
如若莫格利珠单抗能在国内顺利获批上市,可以为国内复发性或难治性皮肤T细胞淋巴瘤患者提供新的用药选择。
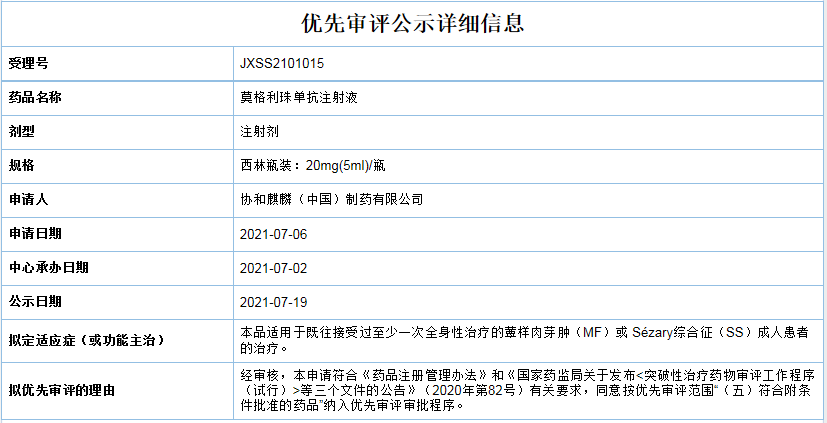
图片来源:CDE
第7项适应症!百济神州百泽安拟纳入优先审评
7月19日,CDE官网显示,百济神州PD-1抗体替雷利珠单抗上市申请拟纳入优先审评,适应症为适用于既往经治的局部晚期不可切除或转移性高度微卫星不稳定型(MSI-H)或错配修复缺陷型(dMMR)实体瘤。
图片来源:CDE
替雷利珠单抗是一款人源化lgG4抗程序性死亡受体1(PD-1)单克隆抗体,设计目的是为最大限度地减少与巨噬细胞中的Fcγ受体结合。此次,百济神州申报上市的适应症为替雷利珠单抗的第七项适应证上市申请。此外,据统计替雷利珠单抗已有五项已经在中国获批。
另据百济神州官网显示,目前其共有15项百泽安®的注册性临床试验在中国和全球范围内开展,其中包括13项3期临床试验,2项关键性2期临床试验。
替雷利珠单抗研发进展图
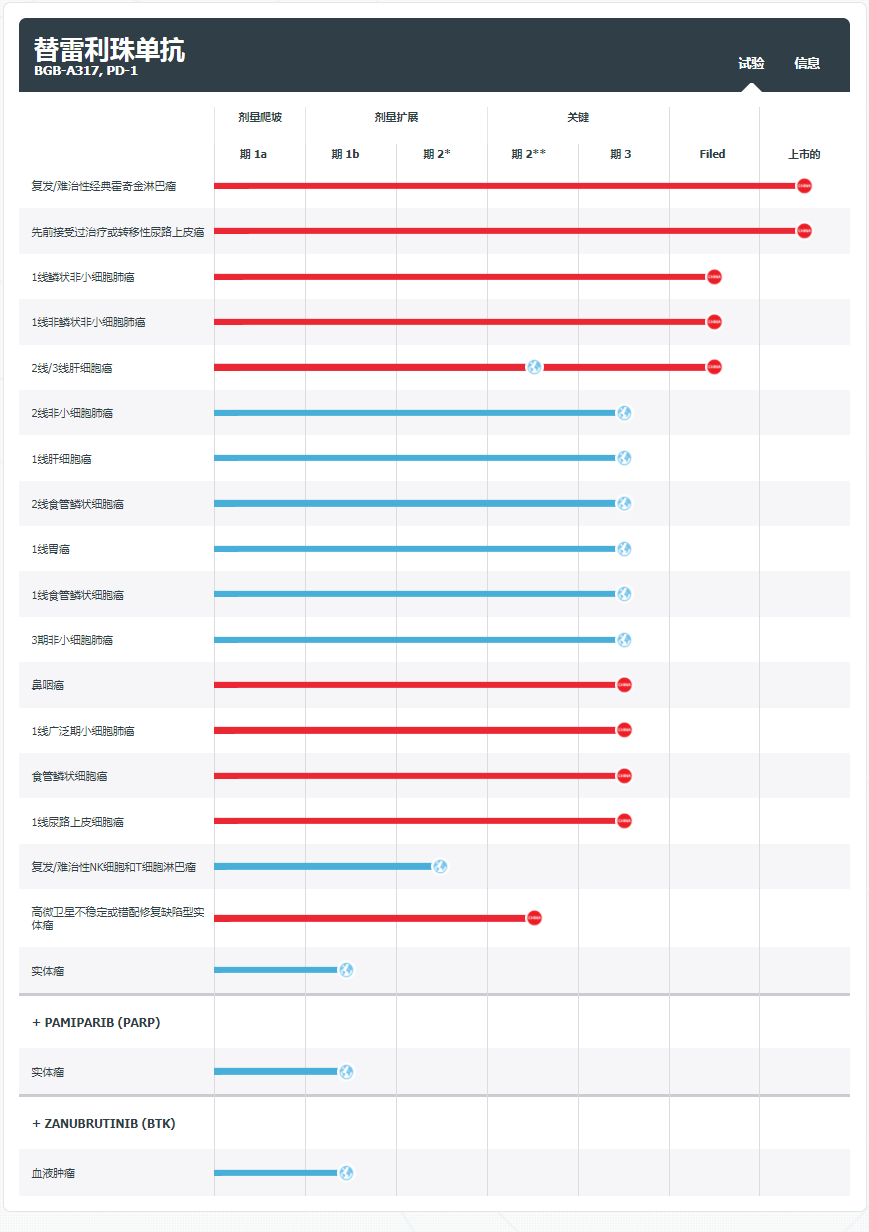
图片来源:百济神州官网
信息与数据来源:药智数据、CDE、企业官网、企业公告等公开数据与信息。