看点:
1、24个新药申请获得临床试验默认许可,包括13个国产1类新药
2、CDE新受理40个新药(66个受理号)的临床试验申请
3、东阳光药1类新药来袭,治疗痛风伴高尿酸血症!
4、中国首个静脉给药的罕见病基因疗法获批临床
药智数据显示,本期(8月6日至8月13日)有24个新药获批临床(38个受理号);涉及17款国产新药,7款进口新药,更多动态如下:
新药临床申请·新获批
本期,24个新药(38个受理号)获得临床试验默示许可,包括13个国产1类新药。获批临床的创新药包括溶瘤病毒、CD47-CAR-T、基因疗法、ERK激酶抑制剂、PD-L1小分子抑制剂、BTK抑制剂、CD38单抗、IL-17A单抗、PD-1/CTLA-4双抗等,适应症包括肿瘤、自身免疫疾病、痛风伴高尿酸血症、精神障碍、罕见病等。
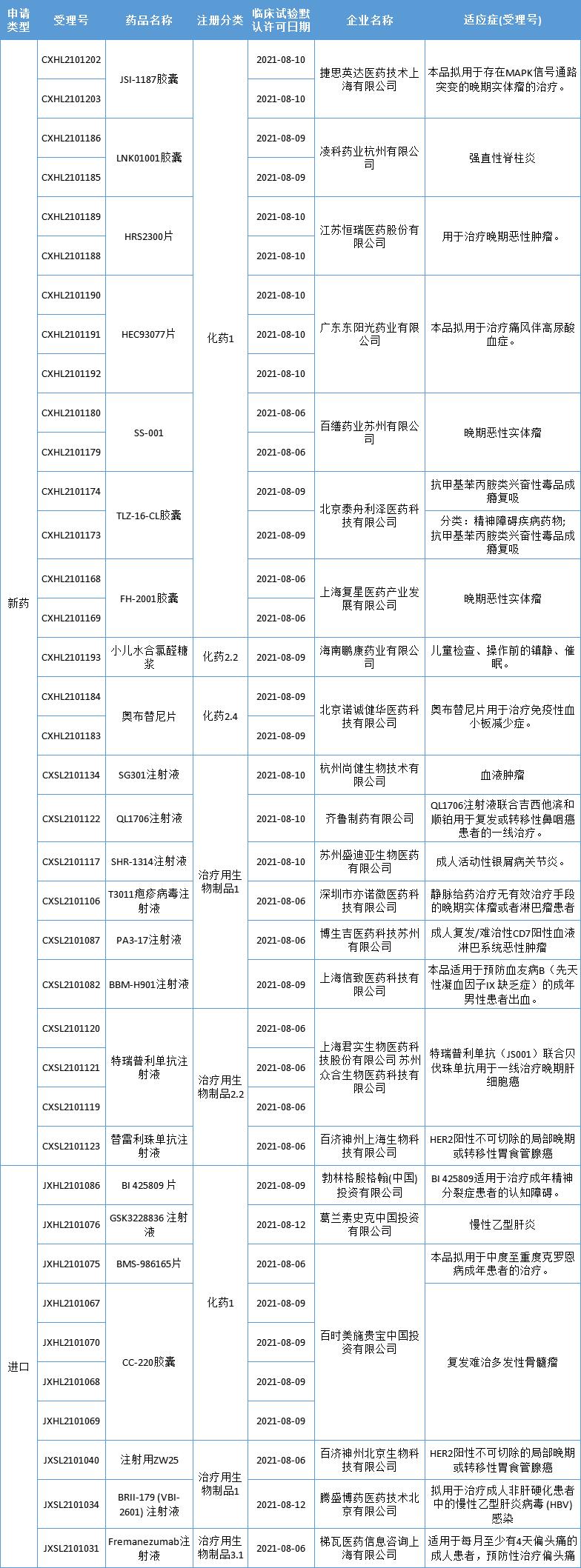
数据来源:药智数据
1.JSI-1187胶囊
该药是一款选择性ERK1/2小分子抑制剂,开发公司为捷思英达医药。ERK是丝裂原活化蛋白激酶(MAPK)信号通路上的一个关键下游蛋白,全球尚无ERK激酶抑制剂获批上市。目前,JSI-1187正在美国进行一期临床试验,评估JSI-1187在携带MAPK突变的复发、难治性实体肿瘤患者中的安全性、耐受性、药代动力学和临床药效。此次,在中国获批临床适应症为用于存在MAPK信号通路突变的晚期实体瘤的治疗。
2.LNK01001胶囊
LNK01001是凌科药业开发的1类新药,也是凌科药业首个申报临床的药物,此前类风湿关节炎适应症已获批临床。本次获批临床适应症为强直性脊柱炎。
3.HEC93077片
东阳光药1类新药HEC93077片获批临床,拟用于治疗痛风伴高尿酸血症。药智数据显示,2021年东阳光药已有6款1类新药获批临床,包括HEC73077片、HEC88473注射液、HEC93077片、HEC116094盐酸盐片、盐酸伊非尼酮片、福瑞赛定片。
4.TLZ-16-CL胶囊
TLZ-16-CL胶囊是由北京泰舟利泽申报的1类新药,属于精神障碍疾病药物,拟用于抗甲基苯丙胺类兴奋性毒品成瘾复吸。
5.FH-2001胶囊
FH-2001 胶囊为PD-L1/FGFR 双机制小分子调节/抑制剂,其临床前研究主要由上海药明康德受托开展,临床研究及后续商业化将由复星医药自主实施。本次获批临床适应症为晚期恶性实体瘤。目前全球范围内尚无靶向PD-L1小分子抑制剂获批上市;中国境内仅有阿斯利康的度伐利尤单抗(英飞凡)和罗氏的阿替利珠单抗(泰圣奇)两款生物制剂获批。但国内已有众多药企布局PD-L1小分子抑制剂,包括红日药业、再极医药、微芯生物、南京圣和、东阳光药业等。中国境内已上市的 FGFR小分子抑制剂主要包括仑伐替尼、瑞戈非尼及帕唑帕尼等。
6.SG301注射液
SG301是尚健生物自主研发的抗CD38人源化单克隆抗体,主要通过Fc依赖性免疫效应机制杀死肿瘤细胞。此外,CD38抗体还可通过消除调节性T细胞、调节性B细胞和髓样来源的抑制细胞来提高宿主抗肿瘤免疫力。7月24日,SG301的新药临床试验申请(IND)正式获得CDE受理,适应症为血液肿瘤。尚健生物新闻稿表示,这是首个中国公司自主研发的CD38单抗申请临床。
7.QL1706注射液
QL1706 是齐鲁制药的一款PD-1/CTLA-4双抗。一方面,QL1706可以结合程序性死亡受体1(PD-1),阻断PD-1与其配体PD-L1和PD-L2 之间的相互作用,让免疫细胞辨别肿瘤细胞,从而发起“攻击”;另一方面QL1706可以结合细胞毒性T淋巴细胞相关蛋白4(CTLA-4),阻断CTLA-4与B7结合,阻止T细胞抑制信号产生,从而增强特异性抗肿瘤的免疫反应。本次获批临床新适应症为联合吉西他滨和顺铂用于复发或转移性鼻咽癌患者的一线治疗。
8.SHR-1314注射液
SHR-1314注射液是恒瑞自主研发的一种靶向人IL-17A的重组人源化单克隆抗体,本次获批临床适应症为成人活动性银屑病关节炎。IL-17是一种重要的促炎症因子,在包括银屑病性关节炎在内的多种自身免疫疾病的病理进程中发挥重要作用,是此类疾病的一个重要治疗靶点。SHR-1314注射液能特异结合IL-17A,从而抑制GROα等细胞因子的产生,达到阻断信号传导通路的作用。目前全球已有2个IL-17A抗体获批上市,分别为诺华公司的secukinumab和礼来公司的ixekizumab,这两款药物分别于2019年4月和9月作为第一批临床急需境外新药在中国获批上市。
9.T3011疱疹病毒注射液
MVR-T3011(亦称T3011)是亦诺微医药拥有自主知识产权的三合一疱疹溶瘤病毒创新产品,此次该产品在中国获批临床,拟开发用于:静脉给药治疗无有效治疗手段的晚期实体瘤或者淋巴瘤患者。值得一提的是,MVR-T3011已于去年5月在美国获得临床许可,用于恶性实体肿瘤治疗,是全球首个在中、美、澳三国同期开展临床研究的溶瘤病毒。
此外,MVR-T3011 IT(瘤内注射)临床研究项目,已展现出良好的安全性和有效性。目前,MVR-T3011 IT已进入中美两地的临床2期试验阶段。2020年8月6日,上海医药与亦诺微签订《授权许可协议》,上海医药拟出资不超过11.5亿元取得新一代抗肿瘤药物T3011(瘤内注射)项目在大中华地区(中国大陆、香港、澳门及台湾)开发、生产和销售等的独占权益。
10.PA3-17注射液
PA3-17注射液是博生吉公司自主研发的国际首款基于纳米抗体的CD7-CAR-T细胞注射液,本次获得临床试验批准的适应症为成人复发、难治性CD7阳性血液淋巴系统恶性肿瘤患者。据悉,CD7阳性的恶性肿瘤大多属于高侵袭性淋巴瘤或者白血病,病程进展快,预后差,大部分病例化疗缓解后短期内就发生复发。对于难治复发性淋巴瘤的治疗,国际上仅有美国FDA批准了奈拉滨(nelarabine)作为其治疗用药,在中国并未上市。博生吉公司研制的自体CD7-CAR-T细胞,避免了基因编辑的相关风险,再加上体内呈现优越的扩增与持续性,因此疗效显著,安全性较高。
11.BBM-H901注射液
BBM-H901注射液是信念医药开发的一款AAV基因治疗药物,适用于预防血友病B(先天性凝血因子IX缺乏症)的成年男性患者出血。这是国内第一个获批进入注册临床试验的静脉给药血友病AAV基因治疗药物,也是国内第一个静脉给药的罕见病基因疗法。据悉,BBM-H901注射液药物的设计采用了肝靶向性血清型和高效基因表达盒,运用该公司自主开发的无血清悬浮培养和层析工艺进行符合GMP要求的药物生产,具有表达效果好、产量高、安全性强的特点。
12.奥布替尼片
诺诚健华奥布替尼在中国获批开展治疗原发免疫性血小板减少症临床II期研究。奥布替尼是诺诚健华自主研发的1类创新药,是具高度选择性的新型BTK抑制剂。2020年12月,奥布替尼获NMPA批准,用于治疗复发/难治慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)、以及复发/难治性套细胞淋巴瘤(MCL) 两项适应症。
13.替雷利珠单抗注射液
百济神州PD-1单抗替雷利珠单抗注射液(商品名:百泽安)新适应症的临床试验申请获国家药监局批准,即将开展用于治疗HER2阳性不可切除的局部晚期或转移性胃食管腺癌的临床研究。替雷利珠单抗已在中国已获批5项适应症,包括霍奇金淋巴瘤、尿路上皮癌、鳞状非小细胞肺癌、非鳞状非小细胞肺癌、肝细胞癌。
新药临床申请·新受理
本期,CDE新受理40新药(66个受理号)临床申请。其中,30个品种(51个受理号)为国产新药,10个品种(16个受理号)为进口新药,更多动态如下:
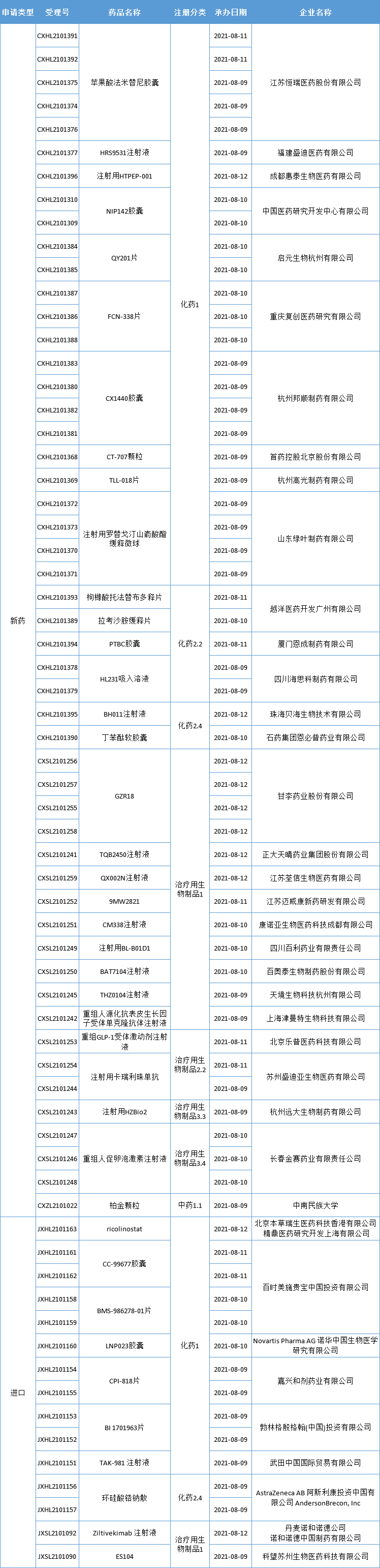
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息