看点:
1、17个新药申请获得临床试验默认许可,包括8个国产1类新药
2、CDE新受理36个新药(46个受理号)的临床试验申请
3、恒瑞多款新药进入临床阶段
4、益普生重磅罕见病新药在中国获批临床
药智数据显示,本期(8月13日至8月20日)有17个新药获批临床(28个受理号);涉及12款国产新药,5款进口新药,更多动态如下:
新药临床申请·新获批
本期,17个新药(28个受理号)获得临床试验默示许可,包括8个国产1类新药。获批临床的创新药包括ADC、CD73单抗、LAG-3单抗、C5a单抗、AKT激酶抑制剂、Bcl-2抑制剂、肺炎疫苗、孤儿药等,适应症包括肿瘤、罕见病、肺炎、 AAV、类风湿关节等。
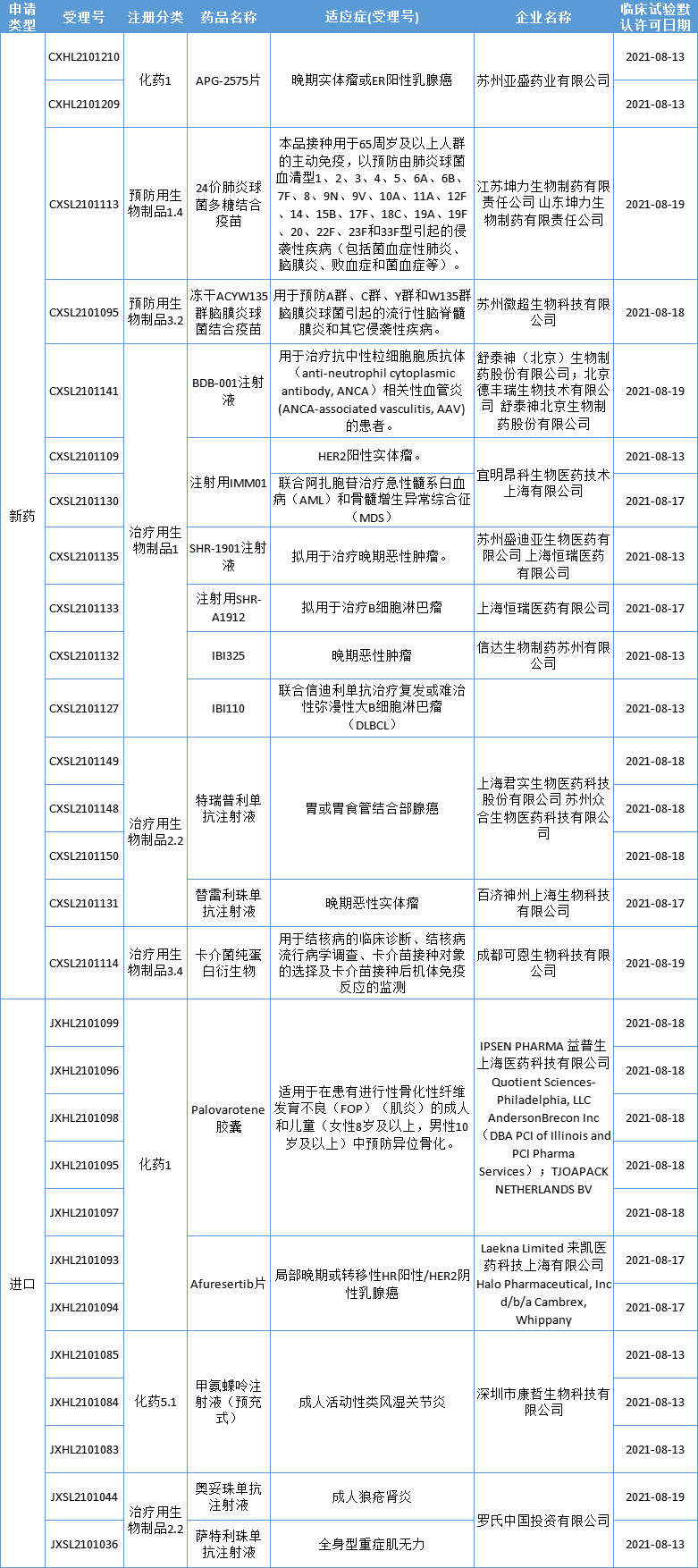
数据来源:药智数据
1.SHR-1901注射液
恒瑞医药SHR-1901注射液获批临床,拟用于治疗晚期恶性肿瘤。
2.注射用SHR-A1912
恒瑞医药注射用SHR-A1912获批临床,拟用于治疗B细胞淋巴瘤。SHR-A1912为恒瑞医药申报的第5款ADC药物,此前申报4款SHR-A1403、SHR-A1201(生物类似药)、SHR-A1811、SHR-A1904。其中SHR-A1403是一款以人源化抗 c-Met 单克隆抗体通过化学偶联微管抑制剂之后形成的ADC,SHR-A1201和SHR-A1811是以 HER2 为靶点的ADC。SHR-A1904和SHR-A1912靶点尚未公开。
3.IBI325
信达生物的CD73单抗IBI325获批临床适应症为晚期恶性肿瘤。CD73又称胞外-5′-核苷酸酶(Ecto-5′-Nucleotidase),是一种细胞表面酶,广泛表达于人体内皮细胞、淋巴细胞,如Treg等细胞表面。据悉,全球范围内尚未有该靶点药物上市,但已有不少在研项目,其中天境生物的uliledlimab进展最快,已经在Ⅱ期临床。
4.IBI110
信达生物IBI110联合信迪利单抗治疗复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)获批开展临床试验。IBI110是一种靶向于淋巴细胞活化基因3蛋白(LAG-3,也称作CD223)的单克隆抗体。LAG-3中文名称为淋巴细胞活化基因-3,是免疫球蛋白超家族的一员,与CD4密切相关,能够选择性的表达在活化的T细胞、NK细胞等免疫细胞表面,与肿瘤、结核等多种疾病相关。全球范围内尚未有该靶点药物上市,但已有不少在研项目,球进展最快的是BMS的relatlimab,正在进行黑素瘤II/III期和胃癌II期临床试验研究。
5.APG-2575片
APG-2575是亚盛医药在研的新型口服Bcl-2选择性小分子抑制剂,通过选择性抑制Bcl-2蛋白来恢复肿瘤细胞程序性死亡机制(细胞凋亡),从而诱导肿瘤细胞凋亡。本次获批临床适应症为晚期实体瘤或ER阳性乳腺癌。该产品正在美国、中国、澳大利亚、欧洲等全球多地开展多种血液肿瘤和实体瘤的临床研究,并已有适应症相继获得FDA授予的孤儿药资格。
6.24价肺炎球菌多糖结合疫苗
江苏坤力生物的24价肺炎球菌多糖结合疫苗在中国获批临床,拟开发适应症为:用于65周岁及以上人群的主动免疫,以预防由肺炎球菌血清型1、2、3、4、5、6A、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17F、18C、19A、19F、20、22F、23F和33F型引起的侵袭性疾病(包括菌血症性肺炎、脑膜炎、败血症和菌血症等)。
7.BDB-001注射液
舒泰神BDB-001注射液获批开展临床试验,拟用于治疗抗中性粒细胞胞质抗体(anti-neutrophil cytoplasmic antibody, ANCA)相关性血管炎(ANCA-associated vasculitis, AAV)的患者。该药是针对C5a靶点的特异性单克隆抗体,可以高效、特异性地抑制C5a信号通路。该产品针对中重度化脓性汗腺炎的适应症已进入2期临床研究阶段。
8.注射用IMM01
注射用IMM01是基于宜明昂科“mAb-Trap”技术平台研发的、具有自主知识产权的新一代免疫检查点抑制剂,针对免疫调节靶点CD47,通过激活巨噬细胞对肿瘤细胞的吞噬作用,并将吞噬处理的肿瘤抗原递呈给T细胞,从而发挥强大的肿瘤免疫治疗效应。本次获批开展2项临床试验,适应症分别HER2阳性实体瘤、联合阿扎胞苷治疗急性髓系白血病(AML)和骨髓增生异常综合征(MDS)。
9.Afuresertib片
Afuresertib是一种口服的小分子泛AKT激酶抑制剂,可强效抑制AKT1、AKT2和AKT3激酶。此前,Afuresertib已经在多种癌症适应症完成了20多项临床1/2期研究,包括卵巢癌、胃癌、多发性骨髓瘤、黑色素瘤等。其中,用于治疗卵巢癌的全球多中心2期临床试验已在中美两国全面展开。此次在中国获批临床,拟开发用于治疗局部晚期或转移性HR阳性/HER2阴性乳腺癌。来凯医药于2018年与诺华(Novartis)公司签署了独家产品授权协议,获得了afuresertib的全球开发,生产和销售权利。
10.甲氨蝶呤注射液(预充式)
甲氨蝶呤注射液(预充式)获批开展成人类风湿关节炎(RA)适应症临床试验。据悉,该试验是一项以甲氨蝶呤口服制剂为对照的非劣效设计临床试验,以便评估产品在中国RA患者中的安全性和有效性。甲氨蝶呤注射液(预充式)产品为多种规格的低剂量小容量甲氨蝶呤注射剂,已获得欧洲药品管理局总部(HMA)批准上市。中国目前没有用于治疗RA的甲氨蝶呤注射剂(含预充式)获批上市。康哲药业于2020年9月从medac Gesellschaft für klinische Spezialpr paratem.b.H(medac)授权引进该药。
11.Palovarotene胶囊
益普生(Ipsen)1类新药palovarotene胶囊获得临床试验默示许可,拟开发用于一种非常罕见的遗传性疾病:在患有进行性骨化性纤维发育不良(FOP)(肌炎)的成人和儿童(女性8岁及以上,男性10岁及以上)中预防异位骨化。Palovarotene是一款新型、选择性视黄酸受体γ(RARγ)激动剂,拟开发用于进行性骨化性纤维发育不良(FOP)、多种骨软骨瘤(MO)、干眼病等多种疾病。该药是益普生以超13亿美元收购Clementia公司所得。美国FDA已接受palovarotene递交的新药上市申请,预计在今年11月30日之前做出回复。此前,palovarotene已获得FDA和欧洲药品管理局(EMA)治疗FOP和MO的孤儿药资格,以及FDA授予的快速通道资格和突破性疗法认定。
新药临床申请·新受理
本期,CDE新受理36新药(46个受理号)临床申请。其中,26个品种(35个受理号)为国产新药,10个品种(11个受理号)为进口新药,更多动态如下:
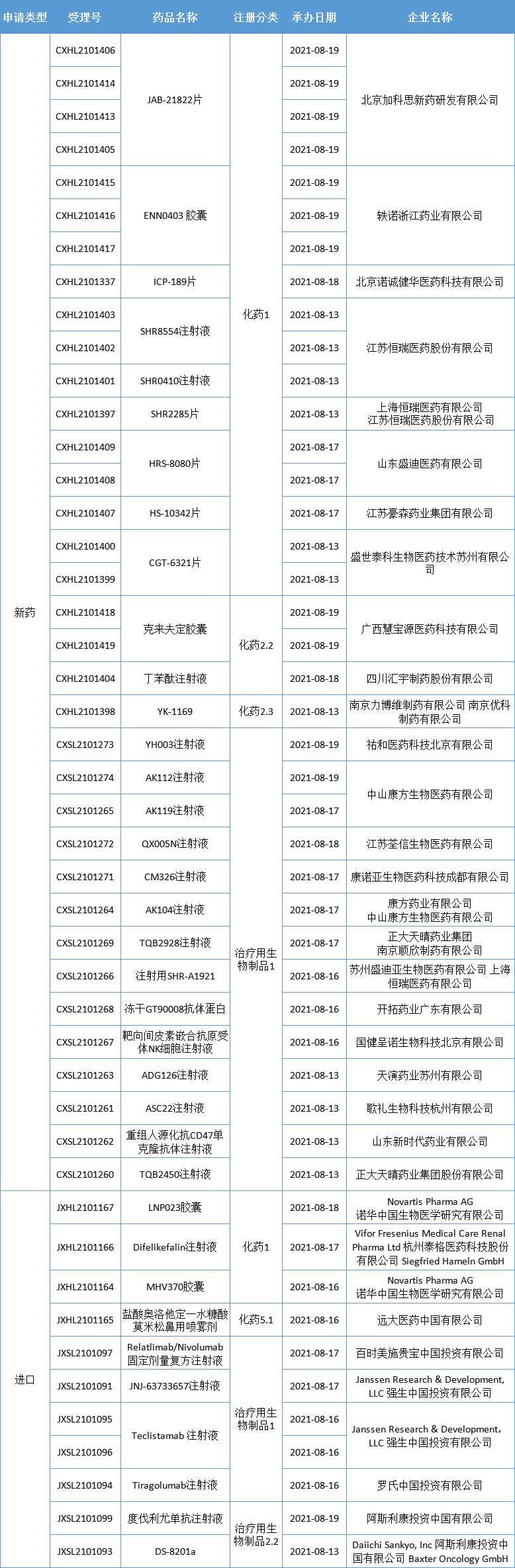
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息