看点:
1、42个新药申请获得临床试验默认许可,包括23个国产1类新药
2、CDE新受理30个新药(38个受理号)的临床试验申请
3、苑东生物首个自主研发1类生物药获批临床!
4、多款双抗获批临床,来自齐鲁制药、普米斯生物、康方生物…
药智数据显示,本期(9月1日至9月10日)有42个新药获批临床(67个受理号);涉及26款国产新药,16款进口新药,更多动态如下:
新药临床申请·新获批
本期,42个新药(67个受理号)获得临床试验默示许可,包括23个国产1类新药。获批临床的创新药包括多种组合双特异性抗体、靶向HER2的ADC、CTLA-4单抗、靶向NGF单抗、白介素22-Fc融合蛋白、FGFR4小分子抑制剂、KRAS小分子抑制剂、肺炎疫苗、中药新药等,适应症包括肠易激综合征,男性勃起功能障碍,类风湿性关节炎、疼痛、肝衰竭、睡眠呼吸暂停、高钾血症,以及肝细胞癌、食管癌、子宫内膜癌、肺癌、肾细胞癌、甲状腺癌、乳腺癌等肿瘤。
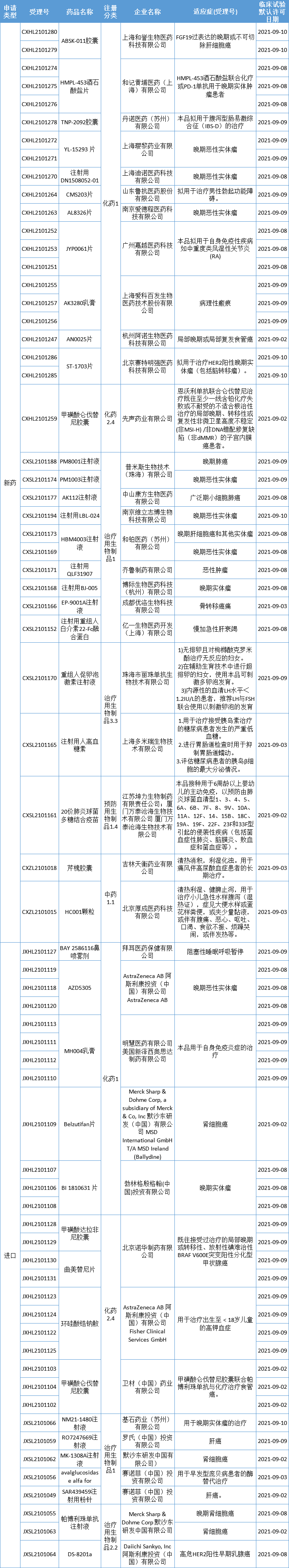
数据来源:药智数据
1、普米斯生物两款双特异性抗体新药获批临床
PM8001注射液是普米斯生物开发的一款PD-L1/TGF-β双特异性抗体。此前,该产品已在中国获批临床,拟开展针对肺癌等晚期肿瘤的临床研究。目前,普米斯生物正在晚期实体肿瘤受试者中开展1期临床试验,及考察初步疗效的2a期临床试验。此次PM8001再次获批临床,拟开发用于晚期肺癌。
PM1003注射液普米斯生物开发的PD-L1/4-1BB双特异性抗体。这类产品可以通过结合PD-L1来阻断PD-1/PD-L1免疫抑制通路,同时还能激活4-1BB下游免疫活化信号,促进免疫细胞对肿瘤细胞的杀伤。这种双靶向机制有望极大增强候选药的抗肿瘤疗效。此次PM1003获批临床,拟开发用于晚期恶性实体瘤。
2、三款PD-L1/4-1BB双抗获批临床
三款靶向PD-L1/4-1BB双特异性抗体获批临床,包括普米斯生物的PM1003、维立志博的LBL-024和齐鲁制药的QLF31907。
截至目前,国内已有多款PD-L1/4-1BB双抗或PD-1/4-1BB双抗进入临床阶段,除本次获批的三款外,还有科望生物的ES101,基石药业的NM21-1480,以及百利药业四抗:GNC-039、GNC-038、GNC-035,信达生物靶向PD-1/4-1BB双抗IBI319。
3、AK112注射液
AK112是康方生物自主研发的一款PD-1/VEGF双特异性抗体。此前,AK112已在中国、澳大利亚等国家开展了剂量爬坡和扩展的1期临床研究。2021年5月,康方生物又分别开展多项单药或联合用药的临床试验,适应症涵盖非小细胞肺癌、复发性卵巢癌、妇科肿瘤等。此次该产品再次获批临床,拟开发用于广泛期小细胞肺癌。
4、注射用BJ-005
BJ-005是博际生物开发的一种重组双功能融合蛋白,可同时靶向PD-L1和TGF-β,通过靶向免疫检查点和调节肿瘤细胞生长的细胞因子途径,从而抑制肿瘤生长,达到癌症治疗的目的。2021年6月,BJ-005在美国获批临床,成为博际生物第2款获FDA临床许可的自主研发产品。此次,该产品在中国获批临床,拟开发用于晚期实体瘤。
5、HBM4003注射液
和铂医药1类新药治疗用生物制品HBM4003注射液两项新适应症获批临床,分别为晚期肝细胞癌和其他实体瘤、晚期恶性实体瘤。HBM4003是全人源的抗 CTLA-4 重链抗体,与传统抗体相比,重链抗体(HCAb)分子量更小,具有更好的组织穿透潜力;还可通过显著增强抗体依赖性细胞介导的细胞毒作用(ADCC),特异性地清除肿瘤微环境中高表达CTLA-4的Treg细胞。临床前研究表明,该产品具有更强的抗肿瘤活性、差异化的药代动力学和药效动力学特征。
6、EP-9001A注射液
EP-9001A注射液为苑东生物首个自主研发的1类生物药,是一种全新作用机制的人源化单克隆抗体药物,靶向人神经生长因子(NGF)。它通过选择性靶向结合并抑制NGF,阻止来自肌肉、皮肤和器官的疼痛信号进入脊髓和大脑,具有与阿片类药物、非甾体类抗炎药等其他镇痛药不同的作用机制。临床前研究显示,EP-9001A注射液对多种疼痛模型均有显著镇痛效果,起效剂量低,镇痛效果强效持久。EP-9001A注射液本次获批的临床研究适应症为骨转移癌痛。目前国内外尚无同类产品获批上市。
7、注射用重组人白介素22-Fc融合蛋白
F-652(注射用重组人白介素22-Fc融合蛋白)是亿帆医药子公司亿一生物开发的1类创新生物药,为利用基因工程技术通过CHO细胞表达的重组人白细胞介素22-Fc(IgG2)融合蛋白。据悉,该产品完全模拟人体白介素22的活性机理,Fc片段大大延长了白介素22的半衰期,在药物疗效方面具有显著提升。截至目前,F-652已在全球范围内完成了5项临床研究,F-652还曾获得FDA授予治疗GvHD的孤儿药资格。此次F-652获批开展的临床研究为一项F-652联合常规方案治疗慢加急性肝衰竭的2期临床试验。
8、ABSK-011胶囊
ABSK-011胶囊是和誉医药自主研发的一款FGFR4口服小分子抑制剂。研究表明FGFR4受体的过度激活与多种癌症(尤其肝细胞癌)的生长、增殖、存活密切相关,通过抑制FGFR4的活性阻滞相关信号传导,有望达到抑制肿瘤生长的疗效。此前,该药已获批针对晚期恶性肿瘤的临床试验,本次获批适应症为,FGF19过表达的晚期或不可切除肝细胞癌。
9、HMPL-453酒石酸盐片
HMPL-453是一种潜在同类最佳高选择性高效小分子抑制剂,对FGFR1/2/3的抑制作用IC50处于低纳摩尔水平。HMPL-453在FGFR异常活化的肿瘤模型中展现出的强效抗肿瘤活性。目前,该产品已在中国启动了晚期恶性间皮瘤的2期临床试验,以及针对晚期肝内胆管癌患者的2期研究。此次HMPL-453在中国获批临床,拟开发适应症为:联合化疗或抗PD-1单抗用于晚期实体肿瘤患者。
10、TNP-2092胶囊
TNP-2092是一款多靶点偶连分子,通过抑制RNA聚合酶、DNA解旋酶和拓扑异构酶IV三个重要靶点实现杀菌作用,具有更强的杀菌活性和更低的耐药频率。该化合物最初由Cumbre研发,2009年4月Cumbre宣布破产,丹诺医药收购了该公司。2019年11月,TNP-2092在中国获得临床试验默示许可,用于治疗肝硬化高血氨症和肝性脑病。此次,该产品新适应症获批临床,拟开发用于腹泻型肠易激综合征(IBS-D)的治疗。
11、YL-15293 片
YL-15293是上海璎黎药业开发的一种KRAS小分子抑制剂,通过与KRAS G12C突变蛋白中的半胱氨酸共价结合将KRAS G12C突变体锁死在失活状态来发挥作用。本次获批开展YL-15293片治疗晚期恶性实体瘤的临床试验。值得一提的是,此前该药已在美国获批临床研究,YL-15293将在中美同步开展临床试验。
12、注射用DN1508052-01
DN1508052-01是迪诺医药开发的一款高效的小分子Toll样受体8(TLR8)激动剂,用于癌症免疫治疗。此前,DN1508052-01已先后在美国和中国获批临床。其中,该产品已在中国获批开展临床研究的适应症为:用于治疗在标准治疗后疾病进展或无标准治疗的晚期实体肿瘤。此次DN1508052-01再次获批临床,拟开发用于晚期恶性实体瘤。
13、JYP0061片
JYP0061是嘉越医药开发的一款1类小分子新药,此次为该产品首次在中国获批临床,拟用于自身免疫性疾病如中重度类风湿性关节炎(RA)。
14、AK3280乳膏
AK3280 是由基因泰克研发的是一种小分子药物。2020年07月,由上海爱科百发生物医药技术有限公司在中国大陆开展临床二期试验,用于治疗特发性肺纤维化。本次获批新适应症:病理性瘢痕。
此外,此次获得临床试验默示许可的1类新药还有:北京赛特明强医药的ST-1703片,拟用于治疗HER2阳性晚期实体瘤(包括脑转移瘤);鲁抗医药的CMS203片,拟用于治疗男性勃起功能障碍;南京爱德程医药的AL8326片,拟用于治疗晚期恶性实体瘤;阿诺生物的AN0025片,拟用于治疗局部晚期或局部复发食管癌;以及吉林天衡药业的中药1类新药芹槐胶囊,适应症为清热消积,利湿化浊,用于痛风伴高尿酸血症患者的长期治疗;北京厚成医药的中药1类新药HC001颗粒,适应症:清热利湿、健脾止泻,用于治疗小儿急性水样腹泻(湿热证),症见大便水样或蛋花样粪便,或夹少量黏液,或伴有腹痛、恶心、呕吐、口渴、食欲不振、烦躁哭闹,或伴发热等。
新药临床申请·新受理
本期,CDE新受理30新药(38个受理号)临床申请。其中,26个品种(34个受理号)为国产新药,4个品种(4个受理号)为进口新药,更多动态如下:
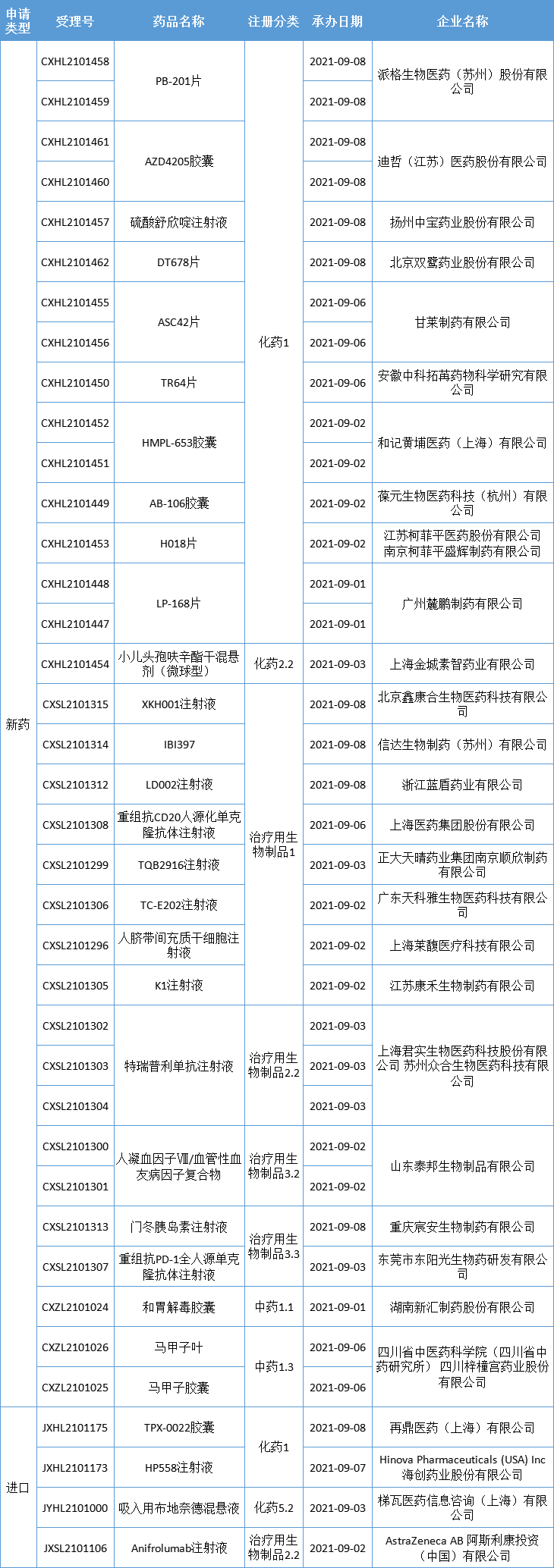
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息