看点:
1、19个新药申请获得临床试验默认许可,包括12个国产1类新药
2、CDE新受理16个新药(21个受理号)的临床试验申请
3、恒瑞4款新药获批临床,多项IND获受理
4、荣昌生物靶向Claudin18.2 ADC获批临床!
药智数据显示,本期(9 月17日至9月26日)有19个新药获批临床(25个受理号);涉及15款国产新药,4款进口新药,更多动态如下:
新药临床申请·新获批
本期,19个新药(25个受理号)获得临床试验默示许可,包括12个国产1类新药。获批临床的创新药包括口服GnRH受体拮抗剂、第三代 BTK 抑制剂、PD-L1/TGFβ双抗、PD-L1/CTLA-4双抗、CD3/CD20 双抗、VEGFR2单抗、TIGIT单抗、靶向Claudin18.2 ADC、ABL1变构抑制剂等,适应症涵盖不孕症、急性肺损伤、iMCD、骨质疏松症、多种实体瘤和血液瘤。
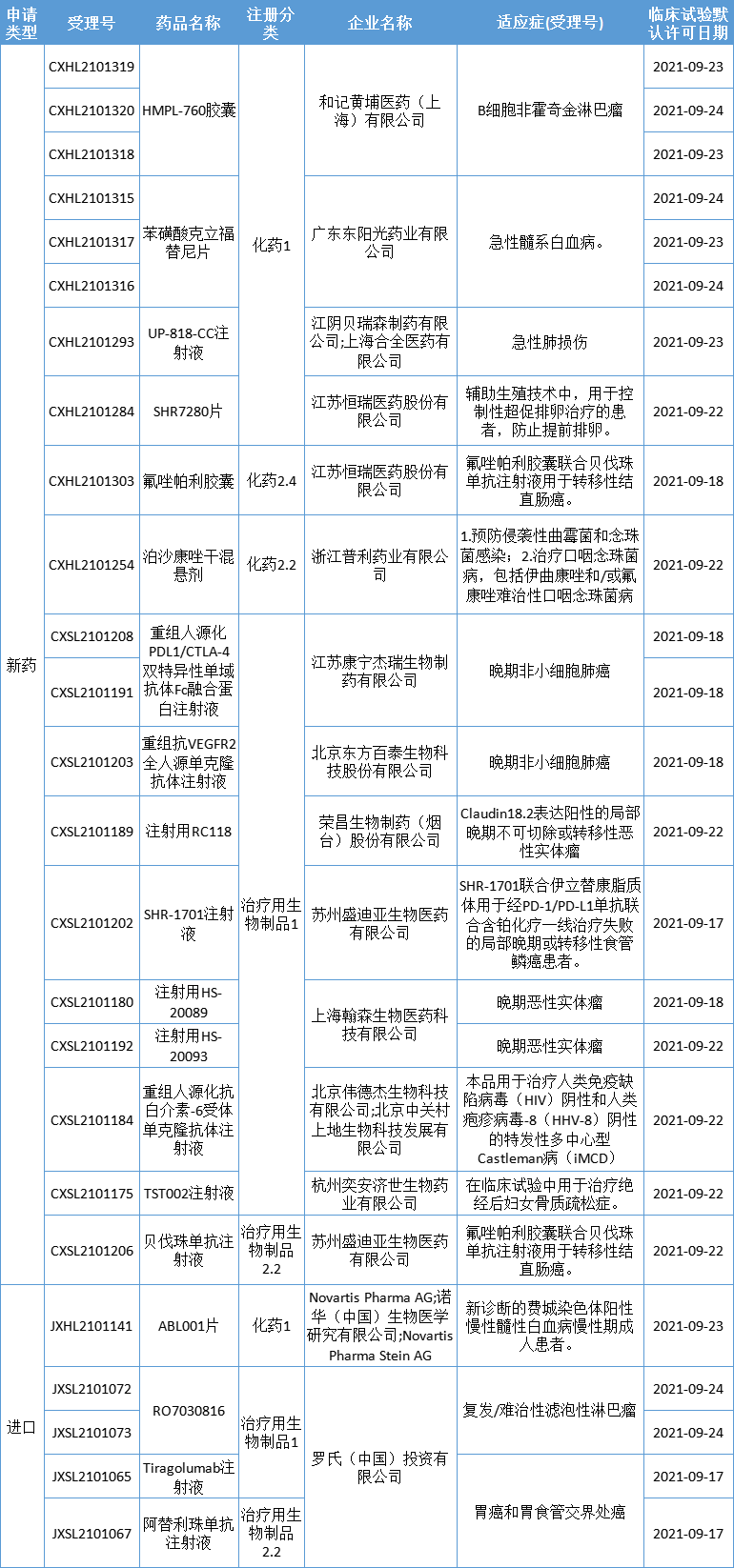
数据来源:药智数据
1.恒瑞多款新药获批临床
SHR7280片
恒瑞医药SHR7280片获批开展用于进行辅助生殖技术(ART)治疗的女性受试者的控制性超促排卵过程中的有效性、安全性及耐受性的多中心、开放II期临床研究。SHR7280是恒瑞医药研发的具有自主知识产权的口服小分子促性腺激素释放激素(GnRH)受体拮抗剂,可以阻断内源性GnRH与GnRH受体的结合,抑制黄体生成素(LH)和卵泡刺激素(FSH)等促性腺激素的合成和释放。在辅助生殖治疗过程中应用SHR7280可抑制早发黄体生成素峰,提高治疗成功率。目前国内外尚无该适应症的口服同类产品获批上市。
SHR-1701注射液
恒瑞医药SHR-1701新适应症临床获批,联合伊立替康脂质体用于经PD-1/PD-L1单抗联合含铂化疗一线治疗失败的局部晚期或转移性食管鳞癌患者。SHR-1701是一款PD-L1/TGFβ双抗,伊立替康脂质体是恒瑞研发的改良型创新药。盐酸伊立替康脂质体注射液联合SHR-1701可通过多重机制共同治疗癌症。
氟唑帕利胶囊/贝伐珠单抗注射液
恒瑞医药氟唑帕利胶囊新适应症临床获批,联合贝伐珠单抗注射液用于转移性结直肠癌。氟唑帕利是一款多聚 ADP 核糖聚合酶(PARP)抑制剂,贝伐珠单抗是一款血管内皮生长因子(VEGF)抑制剂。氟唑帕利联合贝伐珠单抗,有望通过双重机制,起到更好的抗肿瘤效果。
2.豪森两款1类生物创新药获批临床
豪森药业自主研发的治疗用生物制品1类新药,注射用HS-20089和注射用HS-20093临床试验申请(IND)获默认许可,适应症均为晚期恶性实体瘤。
3.HMPL-760胶囊
和记黄埔 1类新药 HMPL-760 胶囊临床申请获默认许可,适应症为:B细胞非霍奇金淋巴瘤。该药是和黄医药(HUTCHMED)自主研发的第三代 BTK 抑制剂,具有可逆、非共价结合野生型及 C481S 突变型 BTK 的能力。目前,全球范围内已获批上市的BTK抑制剂共有5个,分别为伊布替尼、acalabrutinib、泽布替尼、tirabrutinib和奥布替尼。在中国,除了已上市的百济神州的泽布替尼、诺诚健华的奥布替尼外,还有数十款在研的BTK抑制剂,竞争异常激烈。
4.苯磺酸克立福替尼片
东阳光药苯磺酸克立福替尼获批新临床,适应症为急性髓系白血病。据悉,该药是一种FLT-3抑制剂,2017年3月首次获得临床试验批件。
5.UP-818-CC注射液
贝瑞森UP-818-CC注射液获批在国内开展临床试验,拟用于急性肺损伤。根据此前贝瑞森新闻稿,推测该药是新一代抗炎药品,拟开发用于治疗新型冠状病毒造成的急性肺损伤和肺纤维化,慢性阻塞性肺病,新药项目正在进行中欧双报。
6.重组人源化PDL1/CTLA-4双特异性单域抗体Fc融合蛋白注射液
康宁杰瑞PD-L1/CTLA-4双抗KN046又一项注册临床IND获CDE批准,用于PD-(L)1治疗后进展的非小细胞肺癌。这是KN046继鳞状非小细胞肺癌、胸腺癌之后,开展的第三项注册临床研究。此外,KN046在澳大利亚和中国已开展覆盖非小细胞肺癌、胸腺癌、胰腺癌、肝癌、食管鳞癌、三阴乳腺癌等10余种肿瘤的近20项不同阶段临床试验。美国FDA基于在澳大利亚和中国取得的临床试验结果,批准KN046在美国直接进入Ⅱ期临床试验,并于2020年9月授予KN046用于治疗胸腺上皮肿瘤的孤儿药资格。
7.重组抗VEGFR2全人源单克隆抗体注射液
东方百泰重组抗VEGFR2全人源单克隆抗体注射液获得临床试验默认许可,用于治疗晚期非小细胞肺癌。VEGFA/VEGFR-2是诱导血管生成的最主要通路。VEGFR2单抗通过抑制该受体,而抑VEGFR2单抗制肿瘤血管生成,抑制肿瘤生长。
8.注射用RC118
荣昌生物靶向Claudin18.2的抗体偶联药物(ADC)RC118获得临床试验默示许可,适应症为Claudin18.2表达阳性的局部晚期不可切除或转移性恶性实体瘤。这是荣昌生物继维迪西妥单抗(RC48)、RC88、RC108之后开发的第4款ADC产品。值得一提的是,今年7月,RC118已获批在澳大利亚开展I期首次人体临床试验。Claudin18.2是备受各制药公司关注的热门靶点,全球针对该靶点的产品类型包括单抗、双抗、CAR-T,ADC和CARVac,其中,开发中的单抗数量最多。但全球范围内尚未有获批上市的该靶点药物。
9.重组人源化抗白介素-6受体单克隆抗体注射液
北京伟德杰生物开发的重组人源化抗白介素-6受体单克隆抗体新适应症临床获批,用于治疗人类免疫缺陷病毒(HIV)阴性和人类疱疹病毒-8(HHV-8)阴性的特发性多中心型Castleman病(idiopathic multicentric Castleman's disease,iMCD)。此前该药已获批临床适应症包括:用于治疗中度或重度类风湿关节炎;改善病情的抗风湿药物(DMARDs)应答不足的中到重度活动性类风湿性关节炎(RA),及多关节型幼年特发性关节炎(PJIA)、全身型幼年特发性关节炎(SJIA)和Castleman’s Disease。
10.TST002注射液
创胜集团引进新药TST002临床试验申请获默认许可,适应症为用于治疗绝经后妇女骨质疏松症。据悉,TST002(Blosozumab)是一种针对严重骨质疏松的人源化抗硬骨素单克隆抗体候选药物,具有增强骨合成代谢和抗骨吸收的双重作用,可促进骨骼形成并抑制骨质流失,从而在提升骨骼密度和骨骼强度方面快速产生作用。礼来制药已在美国和日本完成临床II期研究并在严重骨质疏松的病人中获得了优异的临床疗效。创胜集团于2019年获得礼来制药在大中华区开发及商业化的授权。
11.ABL001片
诺华公司1类新药ABL001片用于新诊断的费城染色体阳性慢性髓性白血病慢性期成人患者获得临床试验默示许可。不久前,ABL001片首次在中国获批IND,用于既往接受过2种或2种以上酪氨酸激酶抑制剂治疗的慢性髓性白血病慢性期(CML-CP)成人患者。公开资料显示,asciminib(ABL001)是一款ABL1变构抑制剂,曾获得美国FDA授予的快速通道资格、突破性疗法认定,诺华已向FDA提交该药的上市申请(NDA)。
12.RO7030816
罗氏Mosunetuzumab(代号:RO7030816)的IND申请已获NMPA批准,拟用于复发/难治性滤泡性淋巴瘤。Mosunetuzumab是一种T细胞结合CD3/CD20 双抗,目前尚处于临床开发阶段,2020年被FDA授予用于治疗r/r FL的突破性治疗药物资格。
13.Tiragolumab注射液
罗氏Tiragolumab注射液治疗胃癌和胃食管交界处癌获临床试验批准。Tiragolumab一款TIGIT单抗,通过阻断TIGIT与CD155的结合,Tiragolumab可以恢复T细胞免疫功能,并且还有望增加具有干细胞特征的记忆T细胞的数目,从而产生更多的效应T细胞,达到更好的杀伤肿瘤的效果。
14.阿替利珠单抗注射液
罗氏阿替利珠单抗注射液治疗胃癌和胃食管交界处癌获临床试验批准。阿替利珠是一种PD-L1抗体,在中国已获批四项适应症:①联合化疗治疗一线治疗广泛期小细胞肺癌;②联合贝伐珠单抗一线治疗不可切除肝细胞癌(HCC);③一线治疗PD-L1高表达、无EGFR/ALK突变的转移性NSCLC;④联合化疗一线治疗无EGFR/ALK突变的转移性非鳞状NSCLC。
新药临床申请·新受理
本期,CDE新受理16新药(21个受理号)临床申请。其中,13个品种(18个受理号)为国产新药,3个品种(3个受理号)为进口新药,更多动态如下:
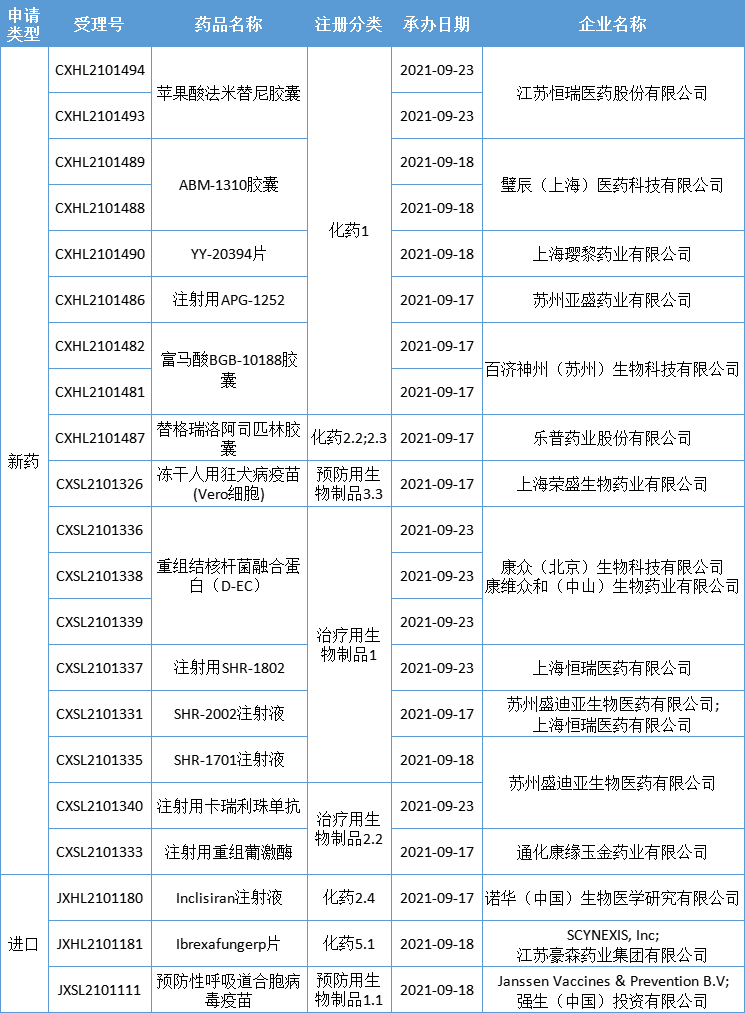
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息