本周看点
1、上海谊众2类新药「注射用紫杉醇聚合物胶束」获批上市!
2、诺和诺德糖尿病新药「德谷胰岛素利拉鲁肽注射液」在中国获批
3、国内第5款!李氏大药厂PD-L1申报上市
4、迈博药业「奥马珠单抗」生物类似药递交上市申请
本期(10月22日至10月29日),糖尿病领域再迎两款新药,PD-1/PD-L1竞争激烈,大批仿制药来袭,更多动态如下:
国内审评审批·新动态
本周CDE有141个受理号(90个品种)报生产办理状态更新,其中上海谊众注射用紫杉醇聚合物胶束、宜昌东阳光甘精胰岛素注射液,以及诺和诺德德谷胰岛素利拉鲁肽注射液备受关注,更多动态如下:

数据来源:药智数据
上海谊众2类新药「注射用紫杉醇聚合物胶束」获批上市!
上海谊众核心产品注射用紫杉醇聚合物胶束(“紫杉醇胶束”)获批上市,适应症:联合铂类适用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可手术切除的局部晚期或转移性非小细胞肺癌(NSCLC)患者的一线治疗。
紫杉醇为治疗肿瘤疾病化疗的基石药物,临床应用广泛。紫杉醇胶束是紫杉醇的创新剂型,属于国家重大新药创制项目。该剂型采用独特的药用辅料,及纳米技术,具有极强的体内稳定性和肿瘤内药物释放的高敏感度。相较于已上市的其它紫杉醇剂型:紫杉醇胶束在临床使用剂量大幅提升的情况下具有相对更好的安全性,临床使用便捷。
又一家甘精胰岛素获批上市
药智数据显示,宜昌东阳光的甘精胰岛素获批上市。甘精胰岛素注射液是由赛诺菲开发的一种新型的胰岛素类似物,具有长效、血药浓度无峰值、平稳地降低患者血糖的作用。
甘精胰岛素是胰岛素集采的品种之一,当前共5家企业获批,包括原研企业赛诺菲以及4家国内企业:甘李药业、通化东宝、珠海联邦制药,和本次获批的宜昌东阳光。此外,山东新时代药业、辽宁博鳌生物、江苏万邦生化也已申报上市,正在审批审批中。
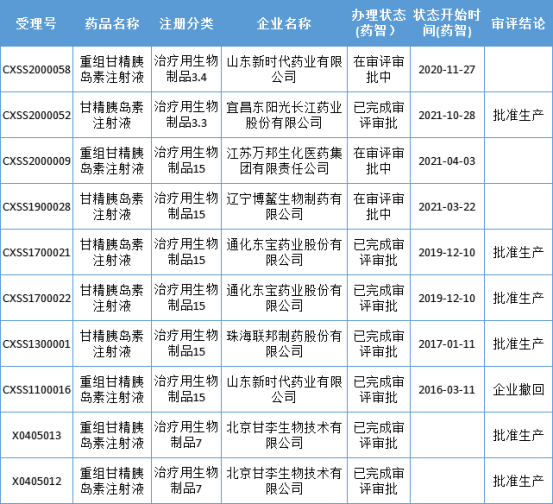
数据来源:药智数据
随着更多胰岛素产品的上市和集采的到来,胰岛素的市场格局面临进一步的洗牌,国产化替代率将进一步提高,国产胰岛素竞争格局更加多元化。
诺和诺德糖尿病新药「德谷胰岛素利拉鲁肽注射液」在中国获批
近日,诺和诺德诺和益® (德谷胰岛素利拉鲁肽注射液)在中国获批上市,用于血糖控制不佳的成人2型糖尿病患者,在饮食和运动基础上联合其他口服降糖药物,改善血糖控制。
据悉,诺和益®是全球首个基础胰岛素胰高糖素样肽-1受体激动剂(GLP-1RA)注射液,由德谷胰岛素和利拉鲁肽组成,突破性融合了德谷胰岛素与利拉鲁肽的双组分优势,两种主要组分通过机制互补发挥作用,一天一次有效控制全天血糖。目前,德谷胰岛素利拉鲁肽注射液已被写入《中国2型糖尿病防治指南(2020年版)》。
国内审评审批·新受理
本周CDE新增报生产受理号44个,共32个品种,其中李氏大药厂首克注利单抗注射液、乐普生物普特利单抗注射液、迈博药业注射用CMAB007,诺华琥珀酸利柏西利片备受关注,更多动态见下表:
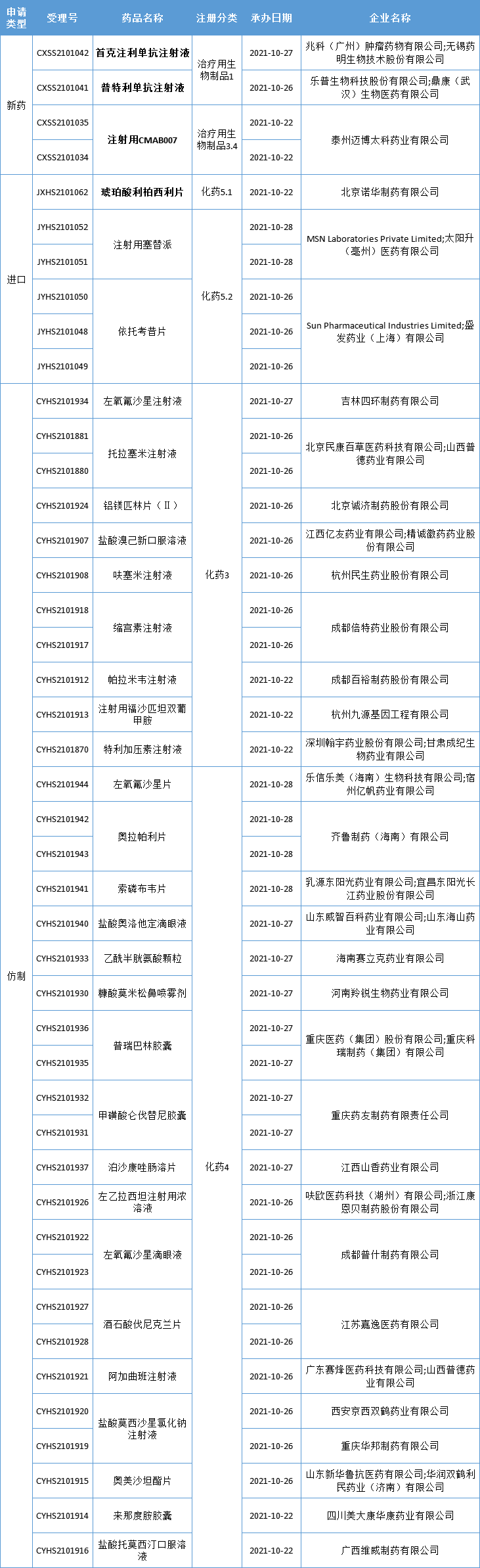
数据来源:药智数据
国内第5款!李氏大药厂PD-L1申报上市
近日,李氏大药厂旗下兆科肿瘤药物递交的抗PD-L1单克隆抗体首克注利单抗注射液(Socazolimab)的新药上市申请已获国家药监局受理,用于治疗复发性或转移性宫颈癌。
Socazolimab为针对肿瘤PD-L1蛋白的全人抗PD-L1单克隆抗体,可以释放由肿瘤细胞引起的免疫系统。Socazolimab为获Sorrento Therapeutics,Inc授权引进中国、香港、澳门及台湾的药品。此前,socazolimab曾被CDE纳入突破性治疗品种,拟定适应症为:接受过一线含铂方案失败或者不能耐受的复发转移性宫颈癌。
根据药智数据,这是国内第5款申报上市的PD-L1,同时也是国内首款申报用于二线宫颈癌的PD-1/PD-L1。其中2款PD-L1单抗已获批上市,分别为罗氏的阿替利珠单抗和阿斯利康的度伐利尤单抗,尚无国产PD-L1获批。思路迪/康宁杰瑞恩沃利单抗,基石药业舒格利单抗已于去年底递交了上市申请,目前处于审评审批阶段。

数据来源:药智数据
除已申报上市的,还有多款国产PD-L1处于临床研究阶段。其中恒瑞SHR-1316(阿得贝利单抗注射液)已完成III期临床研究,预计将于近期申报上市。此外,辉瑞阿维鲁单抗、正大天晴TQB2450、恒智翔医药GR1405均已处于III期临床阶段。
乐普生物PD-1普特利单抗申报第二个适应证
近日,乐普生物PD-1单抗普特利单抗注射液(pucotenlimab,HX008)第二个适应症上市申请获受理,并以“符合附条件批准的药品”被纳入拟优先审评品种公示,适用于既往接受一线及以上系统治疗失败的高度微卫星不稳定型(MSI-H)或错配修复缺陷型(dMMR) 的晚期实体瘤患者的治疗。
公开资料显示,普特利单抗是通过使用人IgG4亚型针对人PD-1的人源化单抗。该药用于黑色素瘤治疗已于今年7月递交上市申请,目前仍在评审中。此外,普特利单抗治疗胃癌及胃食管结合部癌、非小细胞肺癌、三阴性乳腺癌等多项适应证的临床研究正在进行中,其中二线治疗胃癌已开展注册性III期临床研究。
目前,国内外仅有3款抗PD-1单抗获批用于治疗MSI-H/dMMR肿瘤,国产PD-1/PD-L1尚未有该适应证获批。
迈博药业「奥马珠单抗」生物类似药递交上市申请
迈博药业CMAB007(奥马珠单抗生物类似药)上市申请获CDE受理,用于治疗过敏性哮喘。奥马珠单抗为一种重组人源化抗免疫球蛋白E(IgE)单克隆抗体,用于治疗经过中╱高剂量吸入型皮质激素加长效β肾上腺素受体激动剂治疗之后仍然得不到充分控制的哮喘病人的单克隆抗体新药。临床试验结果显示,CMAB007能以较低剂量的吸入糖皮质激素改善哮喘病人的病情及降低急性哮喘发病的概率。
据悉,CMAB007是中国首个递交NDA的国产过敏性哮喘治疗性抗体新药,也是迈博药业第二个递交上市申请的药物。根据迈博药业新闻稿,CMAB007未来预计拓展适应症到慢性特发性荨麻疹、季节性过敏性鼻炎以及食物过敏。
诺华CDK4/6抑制剂「琥珀酸利柏西利片」国内报上市
药智数据显示,诺华公司的CDK4/6抑制剂「琥珀酸利柏西利片」上市申请获国家药监局受理。利柏西利(ribociclib)是一种选择性细胞周期蛋白依赖性激酶抑制剂,通过抑制细胞周期蛋白依赖性激酶4和激酶6(CDK4/6)这两种蛋白,帮助减缓癌症进展。该药最早于2017年3月在美国获批上市,商品名为Kisqali,目前已获批用于多种乳腺癌治疗。
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息