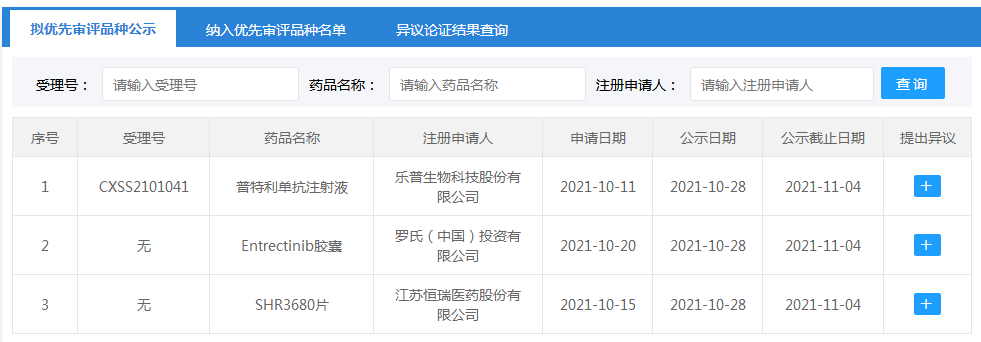
根据国家药品监督管理局药品审评中心(CDE)最新公示,三款新药上市申请被拟纳入优先审评审批,包括乐普生物的PD-1单抗「普特利单抗」,恒瑞医药的「SHR3680片」和罗氏的「Entrectinib胶囊」。
来源:CDE官网
普特利单抗
近日,乐普生物PD-1单抗普特利单抗注射液(pucotenlimab,HX008)第二个适应症上市申请获受理,并以“符合附条件批准的药品”被纳入拟优先审评品种公示,适用于既往接受一线及以上系统治疗失败的高度微卫星不稳定型(MSI-H)或错配修复缺陷型(dMMR) 的晚期实体瘤患者的治疗。
公开资料显示,普特利单抗是通过使用人IgG4亚型针对人PD-1的人源化单抗。该药用于黑色素瘤治疗已于今年7月递交上市申请,目前仍在评审中。此外,普特利单抗治疗胃癌及胃食管结合部癌、非小细胞肺癌、三阴性乳腺癌等多项适应证的临床研究正在进行中,其中二线治疗胃癌已开展注册性III期临床研究。
SHR3680片
恒瑞新型AR拮抗剂SHR3680片以“纳入突破性治疗药物程序的药品”拟纳入优先审评,用于治疗高瘤负荷的转移性激素敏感性前列腺癌(mHSPC)患者。在一项III期SHR-3680-III-HSPC研究中,与标准治疗联合雄激素剥夺疗法(ADT)相比,SHR3680联合ADT在这类患者中达到无影像学进展生存期(rPFS)的主要终点,显著降低患者的疾病进展或死亡风险。9月2日,SHR3680已获CDE突破性疗法认定。
Entrectinib胶囊
罗氏Entrectinib胶囊(恩曲替尼)以“符合附条件批准的药品”拟纳入优先审评,拟定适应症:NTRK融合阳性局部晚期或转移性实体瘤。恩曲替尼是罗氏旗下的一款广谱抗癌药,为针对NTRK和ROS1基因融合的特异性酪氨酸激酶抑制剂,能通过抑制TRKA/B/C和ROS1激酶活性抑制肿瘤细胞增殖。