本周看点
1、奥赛康首款1类新药报上市!
2、首款皮下注射 PD-L1即将获批
3、科伦博泰PD-L1抗体申报上市
4、宜昌人福药业「瑞马唑仑」申报第3项适应症
本期(11月12日至11月19日),第3款国产PD-L1报上市,奥赛康首款1类新药进入上市阶段,宜昌人福镇静药再报新适应症,更多动态如下:
国内审评审批·新动态
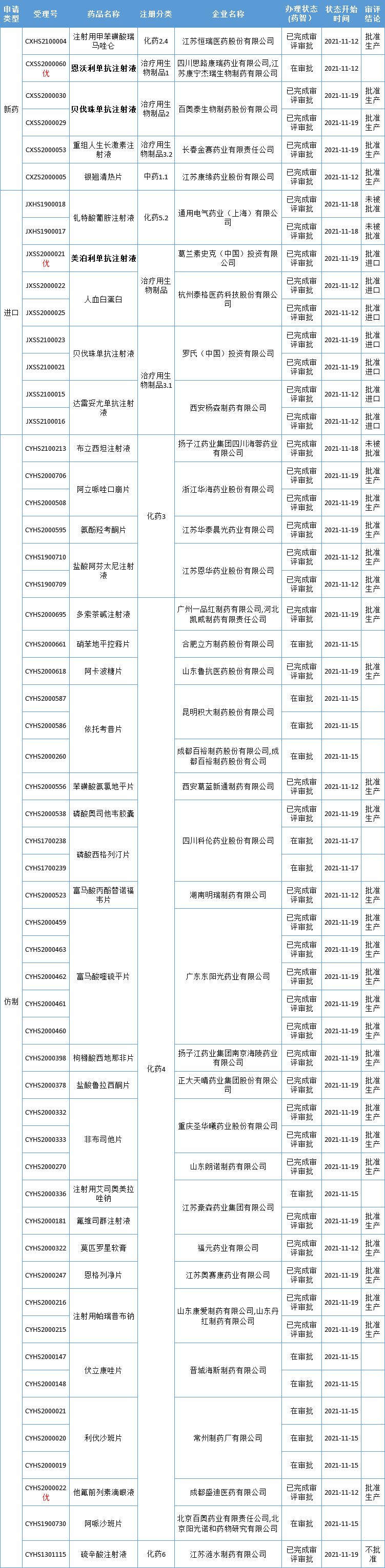
本周CDE有56个受理号(35个品种)报生产办理状态更新,其中康宁杰瑞的恩沃利单抗注射液、百奥泰的贝伐珠单抗注射液,葛兰素史克的美泊利珠单抗注射液备受关注,更多动态如下:
数据来源:药智数据
首款皮下注射 PD-L1即将获批
药智数据显示,恩沃利单抗注射液上市申请已进入“在审批”,有望在近日获批,成为我国首个国产PD-L1抑制剂,同时也是全球首个皮下注射PD-(L)1抑制剂。适应症预计为既往标准治疗失败的微卫星不稳定(MSI-H)结直肠癌、胃癌及错配修复功能缺陷(dMMR)的晚期实体瘤。
恩沃利单抗注射液(研发代号 KN035,通用名:Envafolimab)是康宁杰瑞自主研发的 PD-L1 单域抗体 Fc 融合蛋白,2016 年起与 思路迪医药共同开发;2020 年 3 月, 先声药业获得 KN035 中国大陆肿瘤适应症的独家市场推广权。
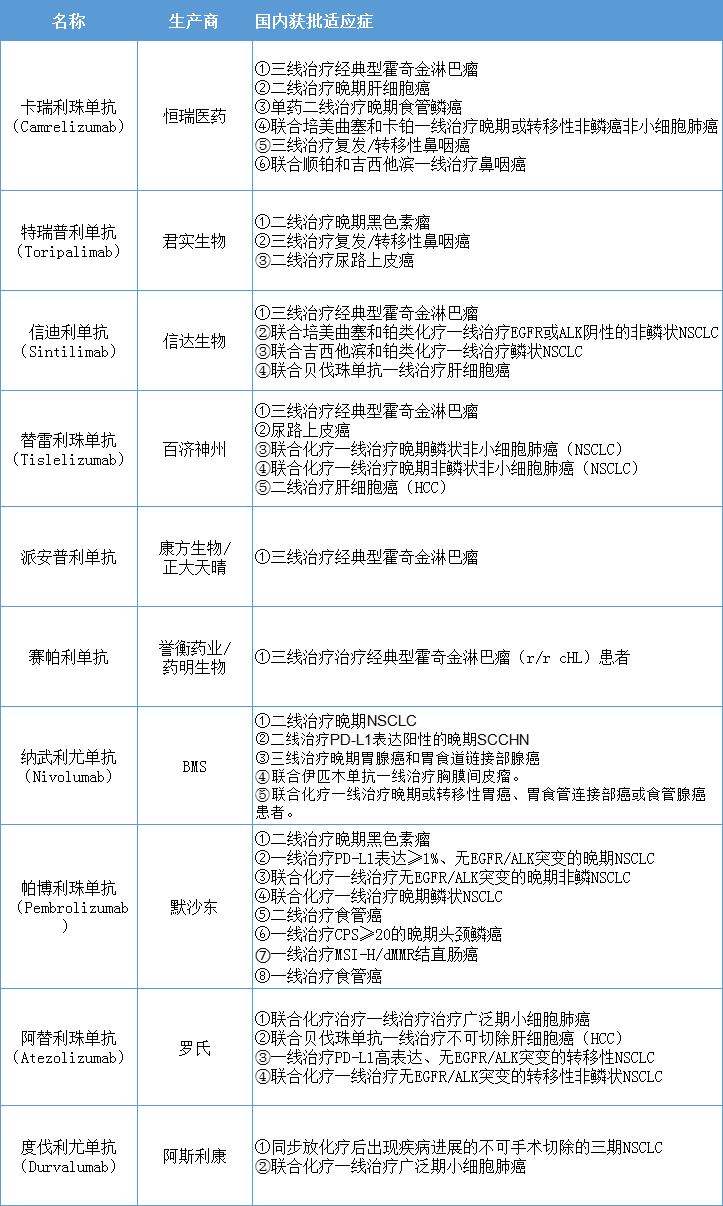
恩沃利单抗若正式获批,我国将拥有11款PD-1/PD-L1。
数据来源:药智数据
此外,复宏汉霖的斯鲁利单抗、嘉和生物的杰诺单抗、乐普生物的普特利单抗也有望今年获批。基石药业舒格利单抗、李氏大药厂Socazolimab、科伦博泰的泰特利单抗也已经申报上市,处于审评审批中。
百奥泰贝伐珠单抗生物类似药获批上市
药智数据显示,百奥泰的贝伐珠单抗生物类似药 BAT1706 已正式获批上市。贝伐珠单抗由罗氏研制,是一种重组人源化抗血管内皮生长因子(VEGF)单抗。原研安维汀®已获批用于治疗以下适应症:转移性结直肠癌,非鳞状非小细胞肺癌,复发性胶质母细胞瘤,转移性肾细胞癌,持续性、复发性或转移性宫颈癌,上皮性卵巢癌,输卵管癌或原发性腹膜癌,以及肝细胞癌。
贝伐珠单抗是国内竞争最激烈的生物类似药,除原研外已有5家企业获批(齐鲁制药、恒瑞药业、信达生物、博安生物、百奥泰),还有企业提交上市申请,竞争异常激烈。
值得一提的是,百奥泰的贝伐珠单抗在获批上市之前就已经在对外授权方面取得进展,将国际市场权益授权给 3 家公司,包括 Cipla(新兴国家)、Biomm(巴西)以及诺华子公司 Sandoz(欧美加及大部分未授权地区),国内权益授权给百济神州。
葛兰素史克「美泊利珠单抗」在中国获批
药智数据显示,葛兰素史克的美泊利珠单抗(mepolizumab,曾用名:美泊利单抗)注射液已获NMPA批准上市,用于嗜酸性肉芽肿性多血管炎(EGPA)成人患者治疗。
美泊利珠单抗是一款“first-in-class”抗IL-5人源化单克隆抗体,也是全球首个获批的抗IL-5单抗。在美国,FDA已批准了美泊利珠单抗的多项适应症,包括重度哮喘、患嗜酸性肉芽肿性血管炎成年患者、成人和12岁以上儿童嗜酸性粒细胞增多症(HES)患者、伴有鼻息肉的慢性鼻窦炎(CRSwNP)患者等等。在中国,美泊利珠单抗的上市申请于2020年7月获得CDE受理,并被纳入优先审评。
国内审评审批·新受理
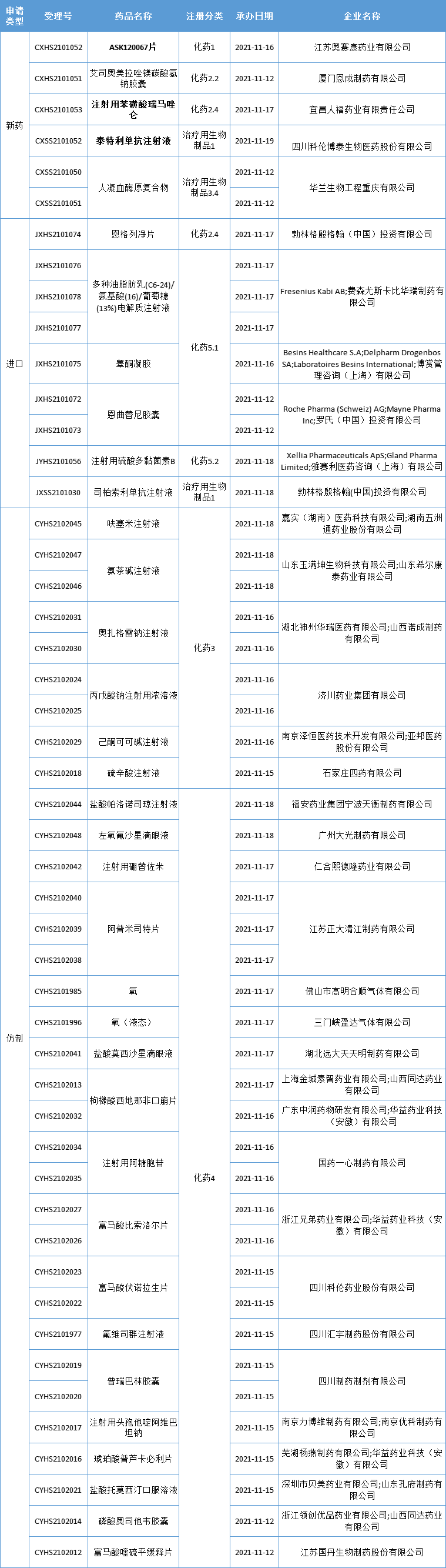
本周CDE新增报生产受理号49个,共36个品种,其中奥赛康药业的 ASK120067 片,宜昌人福药业的注射用苯磺酸瑞马唑仑,科伦博泰的泰特利单抗注射液备受关注,更多动态见下表:
数据来源:药智数据
奥赛康首款1类新药报上市!
近日,江苏奥赛康药业的 ASK120067 片提交了上市申请并获得了CDE受理。
据悉,ASK120067 是由中国科学院上海药物研究所、中国科学院广州生物医药与健康研究院、江苏奥赛康药业有限公司联合开发的具有自主知识产权、全新分子实体、活性显著的口服的第三代 EGFR TKI。拟定适应症:单药用于既往表皮生长因子受体酪氨酸激酶抑制剂(EGFRTKI)治疗中或治疗后出现疾病进展,并且经检测确认存在 EGFR T790M 突变阳性或原发性 T790M 阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。
此外,奥赛康还在开发高选择性 c-Met 抑制剂创新项目,已于 2021 年 8 月 2 日递交 pre-IND 申请。未来与 ASK120067 联合,用于 EGFR 抑制剂耐药的患者,进一步拓展非小细胞肺癌的目标人群。
当前国内三代 EGFR 抑制剂竞争已相当激烈。率先上市的 3 款三代 EGFR-TKI 奥希替尼、阿美替尼和伏美替尼,前两者已经通过谈判进入了医保乙类目录,伏美替尼今年也参与了谈判,据公开信息推测大概率进了。此外,贝达药业/益方生物的贝福替尼、倍而达药业/石药集团的瑞泽替尼,以及奥赛康的ASK120067 已申报上市,还有正大丰海、润新生物、圣和药业等企业的三代 EGFR 抑制剂也已进入临床后期。
而且,四代 EGFR 抑制剂已在开发中。其中,贝达药业的 BPI-361175 已经启动 I/II 期临床,正大天晴的 TQB3804 也已经启动 I 期临床。
宜昌人福药业「瑞马唑仑」申报第3项适应症
药智数据显示,宜昌人福药业提交的“注射用苯磺酸瑞马唑仑”的新适应症上市申请获CDE受理,适应症可能为支气管镜诊疗镇静。
注射用苯磺酸瑞马唑仑(商品名:锐马)是由宜昌人福药业联合德国PAION公司共同开发的新型苯二氮?类药物,为超短效GABAa受体激动剂,可通过组织酯酶代谢,并且代谢产物无活性。
2020年7月,注射用苯磺酸瑞马唑仑通过优先审评程序在中国获批上市,适应症为结肠镜检查的镇静。今年 7 月,人福递交瑞马唑仑第 2 项新适应症上市申请,本周又递交了第 3 项新适应症上市申请。在海外,苯磺酸瑞马唑仑程序镇静适应症上市申请已获得欧洲药品管理局(EMA)和美国FDA批准,全身麻醉适应症上市申请在日本、韩国获批。
科伦博泰PD-L1抗体申报上市
药智数据显示,科伦博泰首个抗体新药PD-L1抗体泰特利单抗已提交上市申请,并获得CDE受理,适应症为霍奇金淋巴瘤。
泰特利单抗(KL-A167)由科伦博泰委托康方生物筛选,专利由科伦博泰持有。2018年,科伦博泰将泰特利单抗的大中华区外权益授权给和铂医药。
目前,已有3款国产PD-L1抗体申报上市,包括基石药业的舒格利单抗、李氏大药厂的Socazolimab、以及科伦博泰的泰特利单抗。
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息