本周看点
1、全球首个皮下注射PD-L1抗体在中国获批上市!
2、亚盛医药第三代BCR-ABL抑制剂在中国获批
3、一线治疗鼻咽癌,君实生物特瑞普利单抗获批新适应症
4、烨辉引进的ROCK2抑制剂在华报产
本期(11月19日至11月26日),多款重磅新药来袭!海思科麻醉创新药再报新适应症,百济神州、烨辉医药引进新药报产新进展,更多动态如下:
国内审评审批·新动态
本周CDE有52个受理号(33个品种)报生产办理状态更新,其中亚盛医药的奥瑞巴替尼片、思路迪医药/康宁杰瑞/先声药业共同合作的恩沃利单抗注射液、君实生物的特瑞普利单抗注射液,以及百济神州的注射用司妥昔单抗备受关注,更多动态如下:
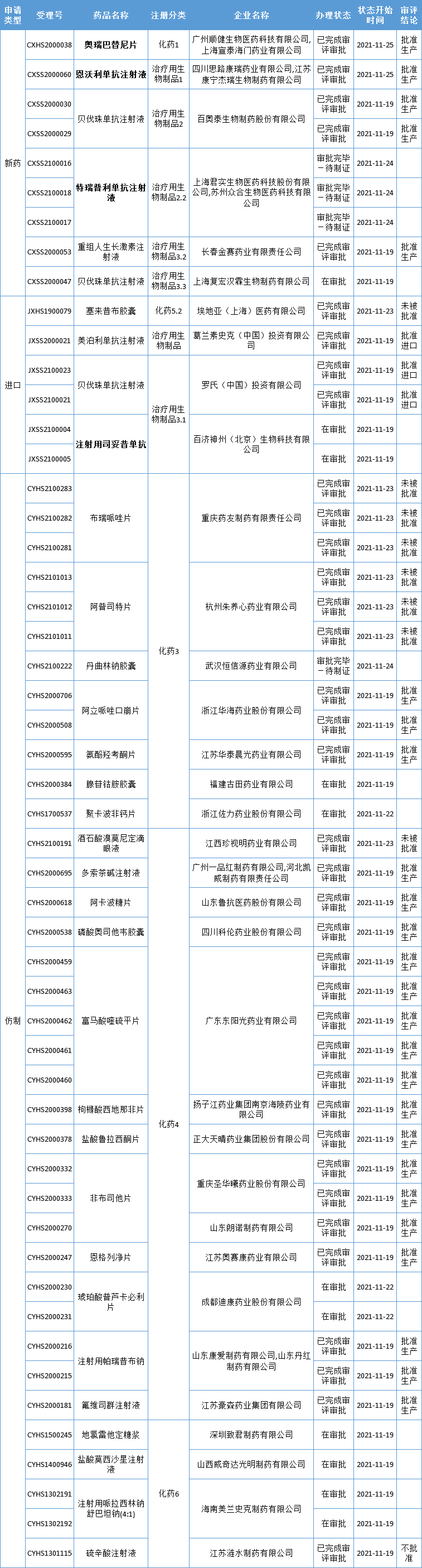
数据来源:药智数据
全球首个皮下注射PD-L1抗体在中国获批上市!
11月25日,国家药品监督管理局(NMPA)附条件批准了思路迪/康宁杰瑞/先声药业共同合作的PD-L1单域抗体恩维达®(恩沃利单抗注射液)上市,用于不可切除或转移性微卫星高度不稳定(MSI-H)或错配修复基因缺陷型(dMMR)的成人晚期实体瘤患者的治疗,包括既往经过氟尿嘧啶类、奥沙利铂和伊立替康治疗后出现疾病进展的晚期结直肠癌患者以及既往治疗后出现疾病进展且无满意替代治疗方案的其他晚期实体瘤患者。
这是我国首个国产PD-L1抑制剂,同时也是全球首个且目前唯一获准上市的皮下注射PD-L1抗体药物。
目前我国已上市11款PD-(L)1抗体药物,恩沃利单抗是唯一一个皮下注射剂型,解决了静脉给药不耐受的肿瘤患者无药可用的未满足的临床需求,比静脉给药节约了大量治疗时间,避免了各种静脉输液不良反应,同时有望从三甲医院住院治疗简化到未来可在社区诊所注射。
亚盛医药第三代BCR-ABL抑制剂在中国获批
11月25日,国家药品监督管理局(NMPA)附条件批准了亚盛医药全资子公司顺健生物的原创1类新药奥雷巴替尼片(商品名:耐立克®)上市,用于治疗任何酪氨酸激酶抑制剂耐药,并采用经充分验证的检测方法诊断为伴有T315I突变的慢性髓细胞白血病慢性期或加速期的成年患者。
奥雷巴替尼(Olverembatinib)为口服第三代BCR-ABL抑制剂,是中国首个获批上市的第三代BCR-ABL靶向耐药CML治疗药物,对BCR-ABL以及包括T315I突变在内的多种BCR-ABL突变体有突出效果,获国家“重大新药创制“专项支持。
奥雷巴替尼凭借其独特优势,在中国曾被纳入优先审评和突破性治疗品种。在海外,奥雷巴替尼接连获得美国FDA授予的孤儿药资格认定和审评快速通道资格,及获欧盟孤儿药资格认定。
2021年7月,亚盛医药与信达生物达成在中国市场就耐立克®共同开发和共同商业化推广的战略合作。
百济神州「司妥昔单抗」即将获批
药智数据显示,百济神州的「注射用司妥昔单抗」上市申请已进入在审批阶段,预计将于近日获批。
司妥昔单抗是一款 IL-6 单抗,用于阻断在卡斯特曼病患者中检测到升高的多功能细胞因子白细胞介素-6(IL-6)的活动。目前,该药已在多个国家和地区获得批准用于治疗 HIV 阴性、HHV-8 阴性的特发性多中心型 Castleman 病(iMCD)患者。
YLVANT®(司妥昔单抗)是百济与 EUSA Pharma 合作的两款单抗之一,属于临床急需境外新药,今年1月被纳入优先审评品种名单,用于治疗人类免疫缺陷病毒(HIV)阴性和人类疱疹病毒8(HHV-8)阴性的多中心卡斯特曼病(多中心Castleman病)成年患者。
一线治疗鼻咽癌,君实生物特瑞普利单抗获批新适应症
药智数据显示,君实生物提交的特瑞普利单抗新适应症上市申请已审批完毕。
特瑞普利单抗注射液(商品名:拓益)是我国批准上市的首个国产PD-1单抗药物。此前,特瑞普利单抗已在国内获批3项适应症,分别为:①二线治疗晚期黑色素瘤;②三线治疗复发/转移性鼻咽癌;③二线治疗尿路上皮癌。本次获批适应症为一线治疗未接受过系统治疗的复发转移性鼻咽癌。
同时,特瑞普利单抗在FDA的首个上市申请(BLA)已获受理并被授予优先审评,它也是首个向FDA提交BLA的国产抗PD-1单抗。目前,特瑞普利单抗已在黏膜黑色素瘤、鼻咽癌、软组织肉瘤领域获得FDA授予2项突破性疗法认定、1项快速通道认定、1项优先审评认定和3项孤儿药资格认定。
国内审评审批·新受理
本周CDE新增报生产受理号51个,共39个品种,其中海思科的环泊酚注射液和烨辉医药的甲磺酸贝舒地尔片备受关注,更多动态见下表:
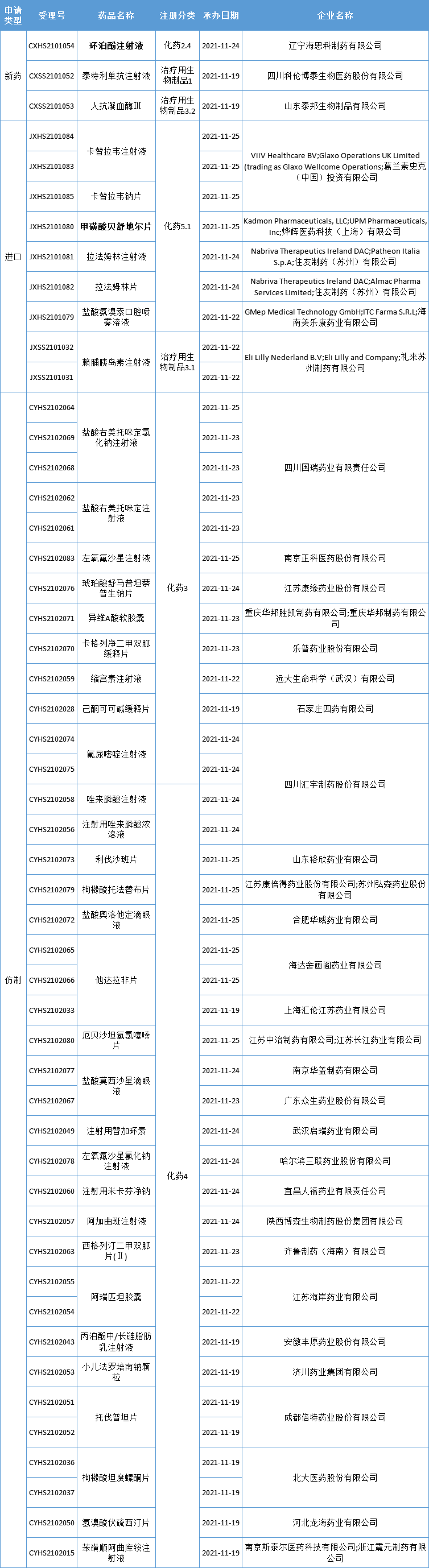
数据来源:药智数据
烨辉引进的ROCK2抑制剂在华报产
药智数据显示,烨辉医药与Kadmon公司开发的选择性ROCK2抑制甲磺酸贝舒地尔片(Belumosudil,KD025/BN101)在中国提交了新药上市申请 (NDA) 。Belumosudil此前曾获NMPA突破性疗法认定,拟用于至少经过一线系统治疗的慢性移植物抗宿主病(cGVHD)患者的治疗。
Belumosudil是first-in-class口服选择性Rho相关卷曲螺旋蛋白激酶2(ROCK2)抑制剂,已于今年7月获美国FDA批准上市,用于治疗先前接受过至少2种系统疗法治疗失败的慢性移植物抗宿主病(cGVHD)儿科患者(年龄≥12岁)和成人患者。FDA还曾授予该药突破性疗法认定和优先审查。
今年9月8日,赛诺菲宣布与Kadmon Holdings签订最终收购协议,以约19亿美元收购了Kadmon全部股份。不过,2019年11月,Kadmon将belumosudil在中国的GVHD适应症开发和商业化权利授权给国内创新药研发公司烨辉医药。故虽然赛诺菲收购了Kadmon,但并未获得belumosudil治疗GVHD的中国权益。
海思科「环泊酚」申报新适应症
药智数据显示,海思科提交的环泊酚注射液(HSK3486)的 2.4 类新药上市申请已获CDE受理。这是环泊酚申报的第 5 个适应症。
环泊酚是由海思科自主研发、具有完全自主知识产权的 1.1 类创新药,同时也是我国首个自主化合物创新的静脉麻醉药。该药是经典麻醉镇静药丙泊酚的改良型新药,其效能显著高于丙泊酚,且安全性好于丙泊酚。
环泊酚注射液的“消化道内镜检查中的镇静”及“全身麻醉诱导”适应症分别于 2020 年 12 月、2021 年 2 月获得国家药品监督管理局批准上市;“支气管镜诊疗的镇静和/或麻醉”和“全身麻醉诱导和维持”适应症上市许可申请分别于 今年 2 月、6月获得国家药品监督管理局受理。本次申报适应症预计为“重症监护期间的镇静”。
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息