本周看点
1、尿路上皮癌迎来首款ADC
2、多款抗感染新药报产迎来新进展
3、百济神州PD-1获批第6项适应症
4、健民药业七蕊胃舒胶囊获批上市
本期(1月1日至1月7日),恒瑞医药囊获两款创新药,维迪西妥单抗和替雷利珠单抗分别获批一项新适应症,中药创新药再次爆发,多款抗感染新药迎来新进展,更多动态如下:
国内审评审批·新动态
本周CDE有51个受理号(37个品种)报生产办理状态更新,其中恒瑞医药的达尔西利、恒格列净,荣昌生物的维迪西妥单抗,百济神州的替雷利珠单抗,以及健民药业的七蕊胃舒胶囊备受关注。更多动态如下:
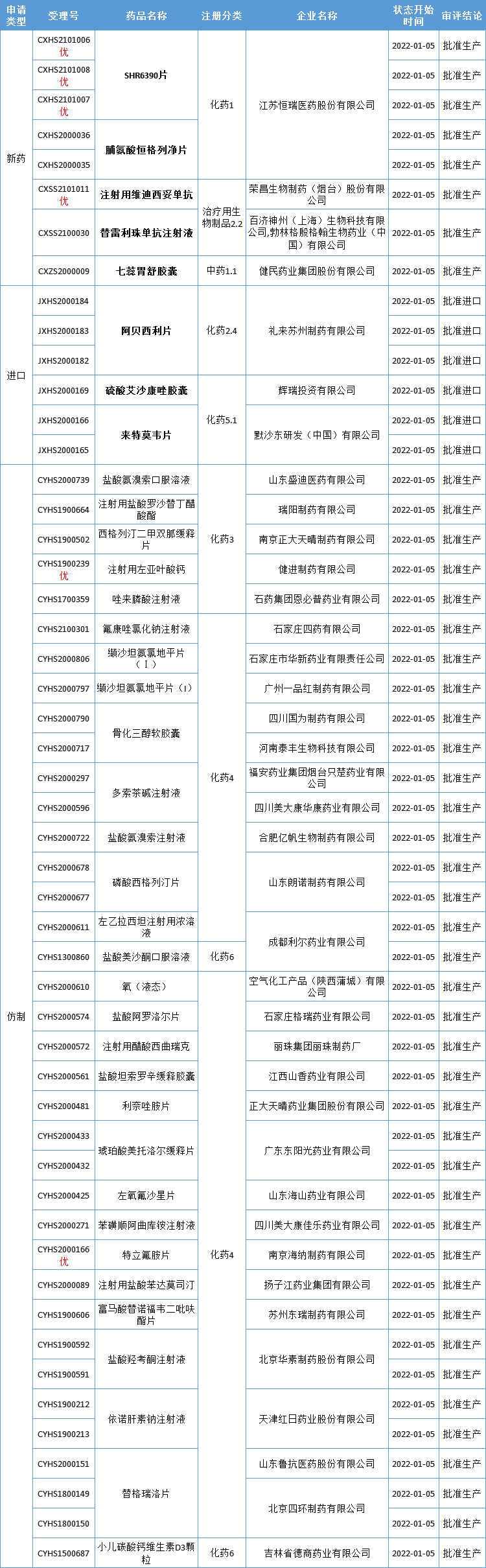
数据来源:药智数据
恒瑞两款新药获批上市
12月31日,国家药品监督管理局(NMPA)通过优先审评审批程序批准了恒瑞医药两款1类创新药的上市申请,分别是羟乙磺酸达尔西利片和脯氨酸恒格列净片。恒瑞医药在中国上市的创新药增至10款,另有13款创新药已经进入了临床3期,或者已经在上市申请的路上。
羟乙磺酸达尔西利片(SHR6390)
达尔西利是首个中国原研CDK4/6抑制剂,本次获批适应症为联合氟维司群用于激素受体(HR)阳性,人表皮生长因子受体2(HER2)阴性的经内分泌治疗后进展的复发或转移性乳腺癌的治疗。
在中国,已有四款CDK4/6抑制剂获得批准,分别是辉瑞的哌柏西利、礼来的阿贝西利、恒瑞医药的达尔西利,以及齐鲁制药的哌柏西利仿制药(辉瑞哌柏西利化合物专利(中国)到期日为2023年1月10日)。此外,国内专利布局“CDK抑制剂”的制药公司,还有上海勋和医药、正大天晴等。
本周,礼来的阿贝西利片在中国也获批了一项新适应症,联合内分泌治疗(他莫昔芬或芳香化酶抑制剂)适用于激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性、淋巴结阳性,高复发风险且Ki-67≥20%早期乳腺癌成人患者的辅助治疗,成为国内首个且唯一被批准用于早期乳腺癌患者的CDK4 & 6抑制剂。这也是阿贝西利片继2020年12月获得NMPA批准用于治疗HR+, HER2-的局部晚期或转移性乳腺癌后,再次获批新适应症。
脯氨酸恒格列净片
恒格列净是目前获批的首个国产创新SGLT2抑制剂,用于改善成人2型糖尿病患者的血糖控制。恒格列净也是恒瑞医药在糖尿病领域的第一个上市创新药。
目前,全球范围内的 SGLT2 抑制剂上市产品包括阿斯利康的达格列净、强生的卡格列净、勃林格殷格翰的恩格列净、默沙东的埃格列净、赛诺菲的索格列净,安斯泰来制药的伊格列净、中外制药的托格列净和大正制药的鲁格列净。
尿路上皮癌迎来首款ADC
药智数据显示,荣昌生物的注射用维迪西妥单抗的新适应症上市申请获得批准,用于治疗既往接受过含铂化疗且HER2过表达即免疫组化检查结果为2+或3+的局部晚期或转移性尿路上皮癌患者。这是国内首个靶向HER2治疗尿路上皮癌的ADC药物。
维迪西妥单抗(爱地希)是一款靶向HER2的抗体偶联药物(ADC),去年6月,该药首次在中国获批,用于至少接受过2个系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗,成为我国首个自主研发的抗体偶联药物(ADC)新药,同年12月3日被纳入新版国家医保目录。尿路上皮癌是维迪西妥单抗获批上市的第二个适应症。此外,该药治疗乳腺癌、肺癌、胆管癌等其他适应症的Ⅱ/Ⅲ期临床研究正在推进,其中乳腺癌适应症被纳入突破性治疗品种。
2021年8月,西雅图基因以高达26亿美元的首付款和里程碑付款以及销售提成获得了注射用维迪西妥单抗的全球(亚太区除外)独家许可协议。
百济神州PD-1获批第6项适应症
本周,百济神州抗PD-1抗体替雷利珠单抗又获批了一项新适应症,用于局部晚期或转移性非小细胞肺癌(NSCLC)患者的二线或三线治疗。这是替雷利珠单抗在中国获批的第六项适应症,也是在中国获批的第三项肺癌适应症,标志着该药既可用于NSCLC的一线治疗,也可用于二线或三线治疗。
替雷利珠单抗获批的适应症包括:
①三线治疗经典型霍奇金淋巴瘤
②尿路上皮癌
③联合化疗一线治疗晚期鳞状非小细胞肺癌(NSCLC)
④联合化疗一线治疗晚期非鳞状非小细胞肺癌(NSCLC)
⑤二线治疗肝细胞癌(HCC)
⑥二线或三线治疗非小细胞肺癌"
此外,美国FDA也已受理百泽安®的上市许可申请用于治疗既往经系统治疗后不可切除、复发性局部晚期或转移性ESCC患者。PDUFA目标日期为2022年7月12日。
2021年1月,诺华就与百济神州达成合作与授权协议,总交易金额达22亿美元,刷新了中国新药“出海”首付金额的历史记录。
健民药业七蕊胃舒胶囊获批上市
近日,据国家药品监督管批准了健民药业的1.1类创新药七蕊胃舒胶囊上市。该药品是在医疗机构制剂基础上研制的中药创新药,开展了随机、双盲、阳性药平行对照、多中心临床试验。临床试验研究结果显示可用于轻中度慢性非萎缩性胃炎伴糜烂湿热瘀阻证所致的胃脘疼痛的治疗。
两款抗感染新药获批进口
硫酸艾沙康唑胶囊
该药是辉瑞公司开发的一款广谱的新型三唑类抗真菌药物。这是硫酸艾沙康唑胶囊侵袭性毛霉病适应症获批后,在中国获批的第二个适应症。目前艾沙康唑已在美国、英国、法国、瑞士等超过60个国家和地区获批。
来特莫韦片
该药是默沙东开发的一款新型非核苷类巨细胞病毒(CMV)抑制剂,是全球首个且目前唯一获批用于异基因HSCT受者预防巨细胞病毒感染的药物。本次在国内获批用于接受异基因造血干细胞移植(HSCT)的巨细胞病毒(CMV)血清学阳性的成人受者[R+]预防巨细胞病毒感染和巨细胞病毒病。
国内审评审批·新受理
本周CDE新增报生产受理号26个,共19个品种,其中恒瑞医药的SHR8008胶囊备受关注,更多动态见下表:
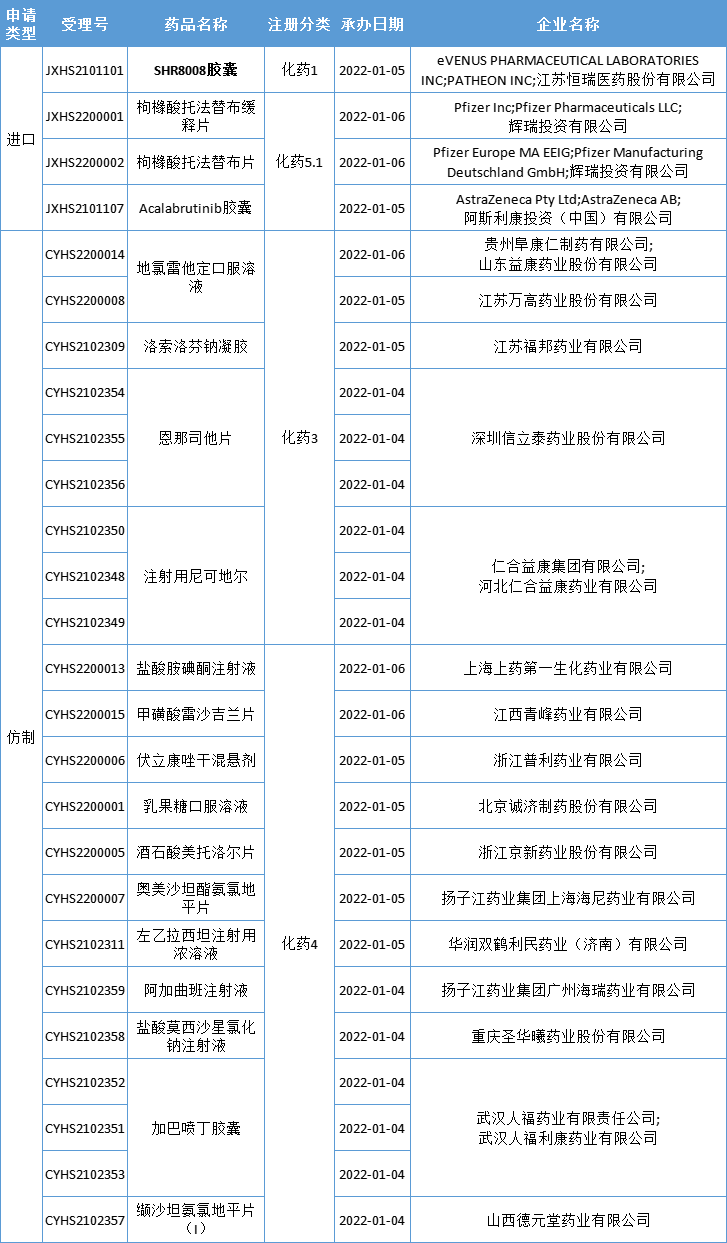
数据来源:药智数据
恒瑞医药引进的新型抗真菌药申报上市
SHR8008是恒瑞医药超1亿美元从Mycovia Pharmaceuticals公司引进的一款新型抗真菌药,本次申请的适应症为急性外阴阴道假丝酵母菌病(VVC,也被称为霉菌性阴道炎、外阴阴道念珠菌病)。根据恒瑞医药11月发布的公告,SHR8008治疗急性VVC的痊愈率显著优于氟康唑。
此外,恒瑞医药还在开展另外一项名为SHR8008-301的3期临床试验,评估SHR8008胶囊治疗复发性外阴阴道假丝酵母菌病(RVVC)的有效性与安全性。在美国,FDA已受理了该药用于治疗RVVC的新药上市申请,并授予其优先审评资格,PDUFA目标日期为2022年1月27日。
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息