2021年1类化药新药临床注册申报总量为1126个(不计补充、复审)。
2021年恒瑞国产1类化药新药临床申请审评完结50个受理号,19个品种,位居第一。
2021年纳入突破性治疗程序6款新药审评完结。
新药临床申请数量作为衡量创新药研发能力的重要指标之一,在新药研发历程中占据着重要地位;2021年全国药品申报依旧呈上升趋势,截止2021年12月31日,CDE受理的受理号个数高达11569个,其中新药申报受理的受理号2749个(补充申请除外),较2020年增加了36.2%;那2021年新药临床注册申报年度审评又是怎样的情况呢?请看以下详细分析报告:
一、2021年新药临床注册申报受理情况
1. 申报总体情况
根据药智注册与受理数据库最新统计,2021年CDE共承办新药临床注册申请以受理号计有2366个(以受理号计,下同)其中化药1492个,中药52个,生物制品822个,年度受理总量较2020年增加了769个,占全国的受理总量比重的20.4 %;2019-2021年CDE新药临床注册申请受理情况详见图1。

图1 2019-2021年CDE新药临床注册申请受理情况(数据截止至2022年01月01日)
数据来源:药智数据、药智咨询整理
新药临床申请CDE公示审评任务分类可分为:IND、临床试验申请和验证性临床三类;在2021年承办新药临床注册申请中:IND申请1522 个(以受理号计,下同),临床试验申请822个,验证性临床申请22个;2021年CDE新药临床注册申请任务分类情况见图2。
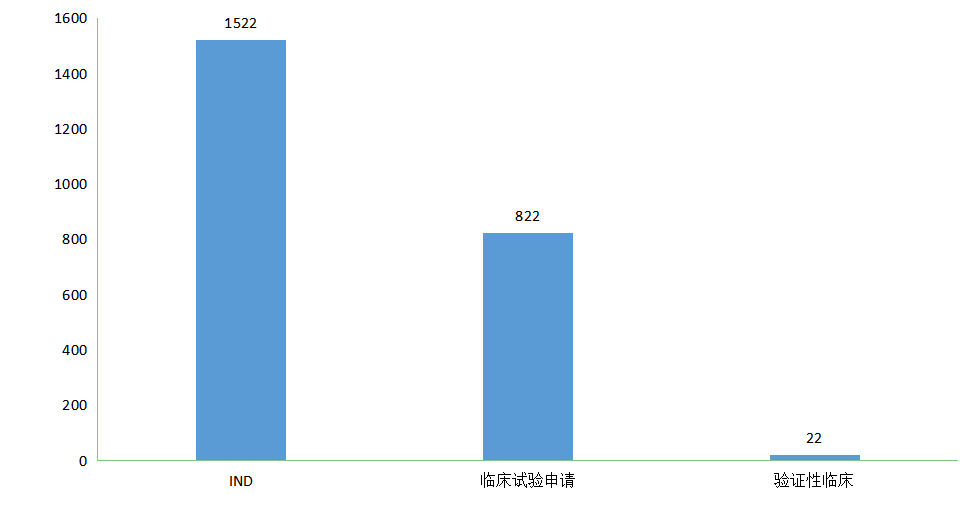
图 2 2021年CDE新药临床注册申请任务分类情况(数据截止至2022年01月01日)
数据来源:药智数据、药智咨询整理
2021年,新药临床申报中化药1类最多,涉及受理号1126个,占总数的49.26%,其次依次为生物制品1类受理606个、化药2类改良型新药受理322个,分别占总数的26.51%和14.09%;(如想了解具体情况,请关注药智注册受理数据库)2021年CDE新药临床申请注册分类情况见图3。
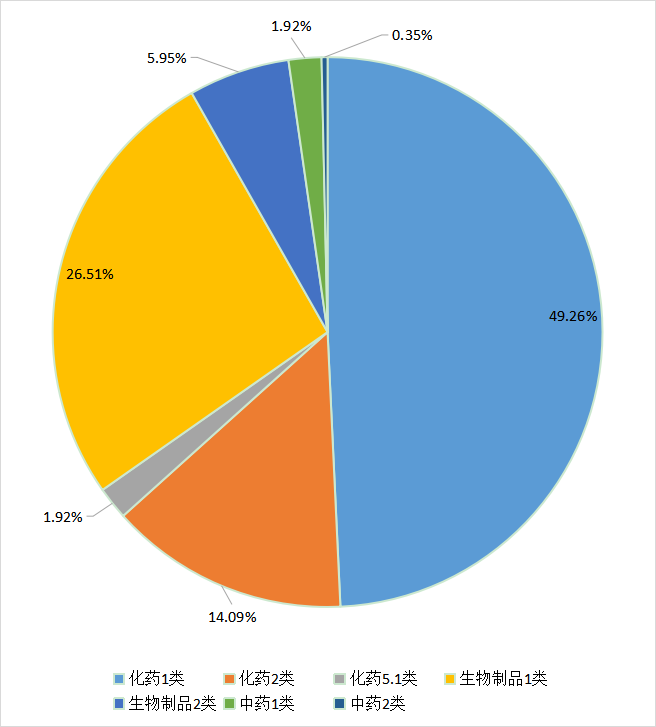
图3 2021年CDE新药临床申请注册分类情况(数据截止至2022年01月01日)
数据来源:药智数据、药智咨询整理
2. 1类化药新药临床申请情况
2021年CDE受理化药1类新药临床申请受理号1126个,其中国产受理号869个,进口受理号257个;根据药智注册与受理数据库统计,在2019-2021年,国产1类新药临床受理数量以40~60%的增长率上升,进口新药临床受理数量在2021年也有了明显增多;2019-2021年1类化药新药临床申请情况详见图4。
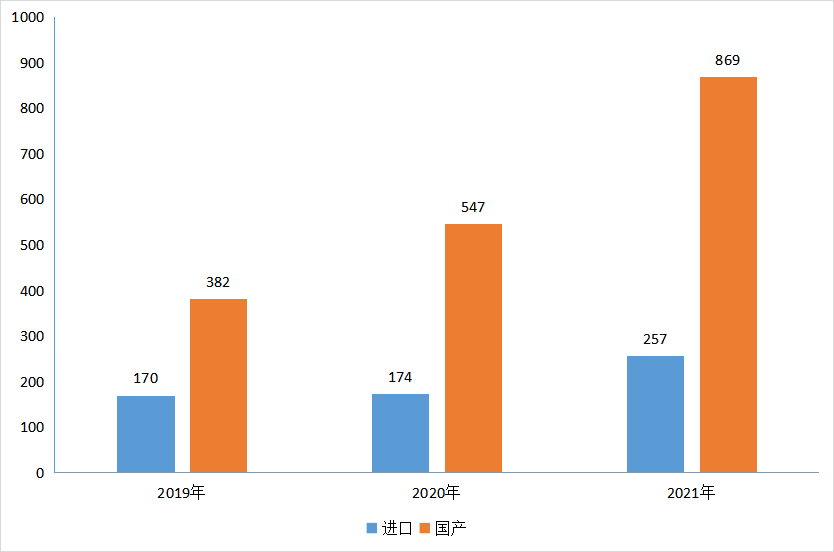
图4 2019-2021年1类化药新药临床申请情况(数据截止至2022年01月01日)
数据来源:药智数据、药智咨询整理
二、2021年新药临床注册审评完结情况
1. 2021年审评完结情况
根据药智注册与受理数据库最新统计,2021年(注:状态开始日期从2021年1月1日至2021年12月31日)CDE新药临床注册申请审评完结受理号数量共计2071个,其中完成最多的药品注册分类为化药1类,完成受理号数据量983个,其次,生物制品1类完成受理号数量500个,化药2类改良型新药完成286个;(如想了解具体情况,请关注药智注册受理数据库)2021年1、2类新药临床申请审评完结情况详见图5。

图 5 2021年1、2类新药临床申请审评完结情况(数据截止至2022年01月01日)
数据来源:药智数据、药智咨询整理
2. 2021年国产1类化药审评完结情况
2021年,CDE完成1类化药新药临床申请审评983个(以受理号计),其中,国产1类受理号741个,进口1类受理号242个;在完成国产1类申请中,江苏恒瑞药业以50个受理号位居第一,涉及19个品种;2021年国产1类化药新药临床申请审评完结企业TOP10情况详见图6(按受理号计数,相同数量企业排名不分先后)。
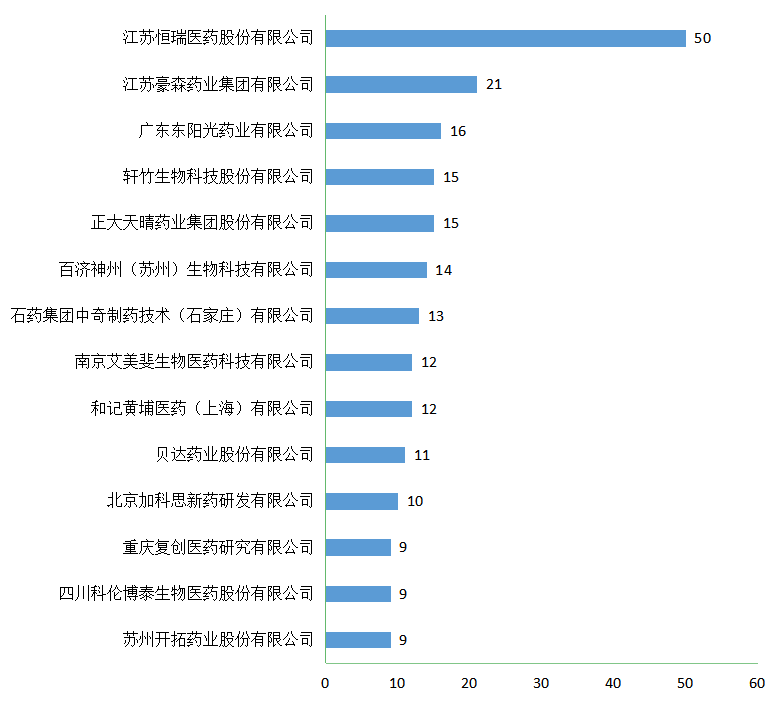
图 6 2021年国产1类化药新药临床申请审评完结企业TOP10情况 (数据截止至2022年01月01日)
数据来源:药智数据、药智咨询整理
3. 2021年新药纳入突破性治疗品种审评完结情况
突破性治疗审评:国家为鼓励研究和创制具有明显临床优势的药物,在药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,申请人可以在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前申请适用突破性治疗药物程序。
2021年,完成突破性治疗程序审评受理号6个,为6个不同品种药物,都已批准临床,其中国产2个,进口4个;2021年纳入突破性治疗新药品种审评完结情况详见表1。
表1 2021年纳入突破性治疗新药品种审评完结情况
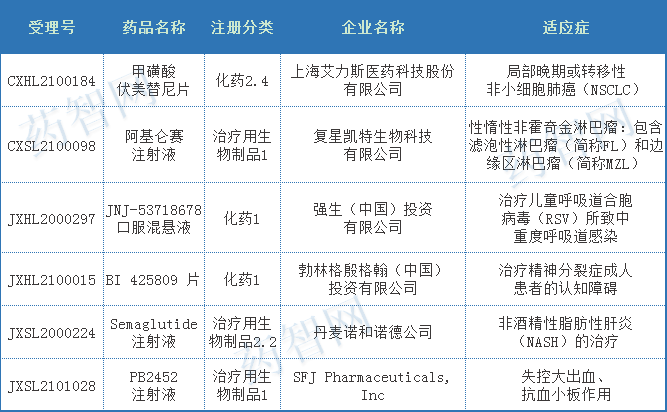
注:数据截止至2022年01月01日。
数据来源:药智药品注册与受理数据库